ГДЗ и решебники по Химии за 11 класс онлайн
Megaresheba.net ВидеорешенияКлассы
- 1 класс
- 2 класс
- 3 класс
- 4 класс
- 5 класс
- 6 класс
- 7 класс
- 8 класс
- 9 класс
- 10 класс
- 11 класс
Предметы
- Русский язык
- Математика
- Английский язык
- Немецкий язык
- Алгебра
- Геометрия
- История
- Биология
- Обществознание
- Химия
- Физика
- География
- Белорусский язык
- Литература
- Информатика
- Астрономия
Решебник ✔️ ГДЗ Химия 11 класс ⏩ А. М. Радецкий Т. Н. Курьянова 2000
М. Радецкий Т. Н. Курьянова 2000
Что даст выпускникам ГДЗ по химии для 11 класса А.М. Радецкий
Химия — это один из самых сложных предметов в школьной программе. Как бы не старался выпускник и как бы тщательно он не работал на хороший аттестат, справиться со свалившейся нагрузкой без помощи пособий он просто не сможет. Именно поэтому, зачастую выпускники вынуждены прибегать к помощи ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000. Издание А.М. Радецкий, Т.Н. Курьянова, ГДЗ по химии для 11 класса, 2000 — это пособие, которое призвано подтолкнуть подростков к более тщательному изучение материала. Дело в том, что химия в выпускном классе преподается на достаточно высоком уровне. Следовательно, во время выполнения письменного задания подросток должен буквально пошагово расписать все свои действия. Только после того, как все хода будут записаны подросток может сверить полученный ответ с тем, который предлагает ГДЗ для 11 класса по химии А.М. Радецкий, Т.Н. Курьянова, 2000 и проверить правильно ли он выполнил задание. Самое главное, что если школьник не усвоит материал и не сможет подробно расписать все свои действия, знание правильного ответа, который он спишет из пособия ему ровным счетом ничего не даст. Именно поэтому, не стоит опасаться, что школьник будет просто списывать правильные ответы и забросит учебу. С ГДЗ для 11 класса по химии А.М. Радецкий, Т.Н. Курьянова, 2000 вариант бездумного списывания невозможен.
Самое главное, что если школьник не усвоит материал и не сможет подробно расписать все свои действия, знание правильного ответа, который он спишет из пособия ему ровным счетом ничего не даст. Именно поэтому, не стоит опасаться, что школьник будет просто списывать правильные ответы и забросит учебу. С ГДЗ для 11 класса по химии А.М. Радецкий, Т.Н. Курьянова, 2000 вариант бездумного списывания невозможен.
Химия в 11 классе — как работать с ГДЗ
Издание А.М. Радецкий, Т.Н. Курьянова, ГДЗ по химии для 11 класса, 2000 открывает перед выпускниками уйму возможностей. Во-первых, работая с ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 школьники имеют возможность повторить пройденный материал не путем зубрежки правил и формул, а за счет решения практических заданий. Во-вторых, при работе с ГДЗ для 11 класса по химии А.М. Радецкий, Т.Н. Курьянова, 2000 у подростков всегда есть возможность подготовиться к контрольной работе за счет выполнения заданий из школьного учебника. Самое главное, что работая с ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 выпускник всегда будет видеть объективную картину относительно того, насколько хорошо он владеет материалом. Именно благодаря ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 идя на контрольную работу школьник будет понимать каковы его реальные шансы получить хорошую оценку, а это значит, что он сможет вовремя подтянуть особо сложные темы.
Самое главное, что работая с ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 выпускник всегда будет видеть объективную картину относительно того, насколько хорошо он владеет материалом. Именно благодаря ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 идя на контрольную работу школьник будет понимать каковы его реальные шансы получить хорошую оценку, а это значит, что он сможет вовремя подтянуть особо сложные темы.
Решение задач по химии, 11 класс — К уроку — Химия
Решение задач. 11 класс.
Получение олеума.
О́леум (лат. Oleum) — раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
xSO3·H2O или H2SO4·xSO3 или H2S2O7;
Олеум
представляет собой вязкую маслянистую
бесцветную жидкость или легкоплавкие
кристаллы, которые, однако, могут
приобретать самые различные оттенки
вследствие наличия примесей. На воздухе
«дымит», реагирует с водой с выделением
очень большого количества тепла.
Концентрация серного ангидрида может
варьировать в очень широких пределах:
от единиц до десятков процентов. Олеум
по сравнению с концентрированной серной
кислотой обладает ещё большим
водоотнимающим и окислительным действием.
Олеум содержит также пиросерные кислоты,
получающиеся по реакциям:
На воздухе
«дымит», реагирует с водой с выделением
очень большого количества тепла.
Концентрация серного ангидрида может
варьировать в очень широких пределах:
от единиц до десятков процентов. Олеум
по сравнению с концентрированной серной
кислотой обладает ещё большим
водоотнимающим и окислительным действием.
Олеум содержит также пиросерные кислоты,
получающиеся по реакциям:
Физические свойства
Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме, общее давление пара над ним повышается.
Пар
над водными растворами серной кислоты
состоит из смеси паров воды, H2SO4 и SO
С повышением температуры усиливается диссоциация:
Применение
Применяется в промышленности при производстве серной кислоты, капролактама и многих других веществ. В органической химии применяется как сульфирующий, водоотнимающий или окисляющий реагент.
Особенности экспериментальной работы
Олеум — крайне едкое вещество: оставляет сильные ожоги на коже, быстро разъедает многие материалы, за исключением наименее реакционноспособных. Тем не менее, вследствие эффекта пассивации может храниться в стальных ёмкостях. Олеум нельзя разбавлять водой или выливать его в воду, из-за сильно экзотермической реакции
. Разбавление олеума производится прибавлением его к серной кислоте. При приливании в воду жидкость закипает, образуя туман из серной кислоты.Задача 1.
К 75 %-му раствору серной кислоты массой
288 г добавили оксид серы (VI)
массой 400 г. Вычислите массовую долю
оксида серы (VI) в
образовавшемся олеуме.
Вычислите массовую долю
оксида серы (VI) в
образовавшемся олеуме.
Решение:
т (Н2О)= 288 – 216 = 72 г.
Часть оксида серы (VI) вступит в реакцию с водой. Всего оксида серы (VI) 5 моль. На реакцию с водой потратится 4 моль оксида серы (VI). Останется 1 моль оксида серы (VI).
SO3 + H2O = H2SO4. По уравнению химической реакции все вещества находятся в равных количественных соотношениях.
n (SO3
n (H2O) =72 г/18 г/моль = 4 моль.
n (SO3) = 5 моль-4 моль = 1 моль.
m (SO3)ост. = 80г/моль * 1 моль = 80 г.
m (H2SO4) = 4моль*98 г/моль = 392 г.
m p-pa = 288+400 = 688 г.
= 11,6 %. Ответ: 11,6 %.
Задача 2.
К 92 %-му раствору серной кислоты массой 562,5 г. добавили оксид серы (VI) массой 240 г. Вычислите массовую долю оксида серы (VI) в образовавшемся олеуме.
Решение:
т (Н2О)= 562,5 – 517,5 = 45 г.
Часть оксида серы (VI) вступит в реакцию с водой. Всего оксида серы (VI) 3 моль. На реакцию с водой потратится 2,5 моль оксида серы (VI). Останется 0,5 моль оксида серы (VI).
SO3 + H2O = H2SO4. По уравнению химической реакции все вещества находятся в равных количественных соотношениях.
n (SO3) =
n (H2O) =45 г/18 г/моль = 2,5 моль.
n (SO3) = 3 моль-2,5 моль = 0,5 моль.
m (SO3)ост. = 80г/моль * 0,5 моль = 40 г.
m p-pa = 562,5+240 =802,5 г.
= 4,98 %. Ответ: 4,98 %.
Ответ: 4,98 %.
Задача 3.
Вычислите массу оксида серы (VI), который необходимо добавить к 20 %-му раствору серной кислоты массой 200 г, чтобы получить 10 %-ный олеум.
Решение:
SO3 + H2O = H2SO4. n (SO3) = 8,89 моль.m (SO3)вступ. в р-ю с Н2О= 80г/моль * 8,89 моль = 711,2 г.
Пусть масса оставшегося непрореагировавшим оксида серы (VI) – х, тогда
Х= 20 + 71,12 + 0,1х
0,9х = 91,12
х = 101,2 г.
масса всего оксида серы (VI)
m (SO3) = 711,2 + 101,2 = 812,4 г. Ответ: 812,4 г.
Задача 4.
Вычислите массу оксида серы (VI),
который необходимо добавить к 90 %-му
раствору серной кислоты массой 250 г,
чтобы получить 20 %-ный олеум.
т (Н2О)= 250 – 225 = 25 г. n (H2O) =25 г/18 г/моль = 1,39моль.
SO3 + H2O = H2SO4. n (SO3) = 1,39 моль.m (SO3)вступ. в р-ю с Н2О= 80г/моль * 1,39 моль = 111,1 г.
Пусть масса оставшегося непрореагировавшим оксида серы (VI) – х, тогда
Х= 50 + 22,22 + 0,2х
0,8 х = 72,22
х = 90,3 г.
масса всего оксида серы (VI)
m (SO3) = 90,3 + 111,1 = 201,3 г. Ответ: 201,3 г.
Задача 5.
Вычислите массу 50 %-ной серной кислоты и массу оксида серы (VI), которые необходимо взять, чтобы получить 200 г 20 %-ого олеума.
Решение:
Можно определить сколько осталось
оксида серы (VI) в олеуме.
, m (SO3) = 40 г.
Пусть масса вступившего в реакцию с водой оксида серы (VI) – х, тогда всего m (SO3) = х + 40
По уравнению: SO3 + H2O = H2SO4
n (SO3) = = 0,225 х ;
Пусть m p.в. Н2S O4 – y, тогда:
Масса олеума 200 г, тогда:
200 = х + 40 + y + 0.225 x ; 160 = 1.225 x + y ;
160 = 1.225 x + 0.225 x
160 = 1.45 x ; x = 110.3 ; y = 24.8
т (Н2О)= 24.8 г.
m (SO3) = 110,3 + 40 = 150,3 г.
m p-pa H2SO4 = 24,8 + 24,8 = 49,6 г. Ответ: 49,6 г и 150,3 г.
Задача 6.
Вычислите массу оксида серы (VI)
и массу 25 %-ого раствора серной кислоты,
необходимых для приготовления 20 % -ого
олеума массой 400 г.
Решение:
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 80 г.
Пусть масса вступившего в реакцию с водой оксида серы (VI) – х, тогда всего m (SO3) = х + 80
По уравнению: SO3 + H2O = H2SO4
n (SO3) = = 0,225 х ;
Пусть m p.в. Н2S O4 – y, тогда:
Масса олеума 400 г, тогда:
400 = х + 80 + y + 0,225 x ; 320 = 1,225 x + y ;
320 = 1,225 x + 0,075 x
320 = 1,3 x ; x = 246,2 ; y = 18,5
т (Н2О)= 55.4 г.
m (SO3) = 80 + 246,2 = 326,2 г.
m p-pa H2SO4 = 18,5 + 55,4 = 73,9 г. Ответ: 326,2 г. и 73,9 г.
Задача 7.
Вычислите массу серного ангидрида и массу 40 %-ого раствора серной кислоты, необходимых для приготовления 200 г 16 %-ого олеума.
Можно определить сколько осталось оксида серы (VI) в олеуме.
, m (SO3) = 32 г.
Пусть m p.в. Н2S O4 – х, тогда: m p-pa H2SO4 = 100х/40 = 2,5 х
200 = 2,5 х + 32 + m (SO3)прор.
т (Н2О) в р-ре H2SO4 =2,5 х – х = 1,5 х
n (H2O) =
n (SO3) =
m (SO3)прор. = 80г/моль * = г.
200 = 2,5 х + 32 + ; 27,5 х = 504 ; х = 18,3
Следовательно: m p-pa H2SO4 = 45,8 г.
m (SO3)прор.
= 122,2г. m (SO3)ост. = 32 г. m (SO3)
= 154,2 г.
= 32 г. m (SO3)
= 154,2 г.
Ответ: 154,2 г. и 45,8 г.
Использованы для статьи:
Материал из Википедии — свободной энциклопедии. Олеум.
Задачник по химии: 11 класс. А.Н. Левкин, Н.Е.Кузнецова.- М., Вентана-Граф, 2009.
Автор статьи «Решение задач»: учитель химии высшей категории МКОУ СОШ №1 г. Усть-Катава
Щурихина Фларида Фасхетдиновна.
Решебник по химии за 11 класс, ответы онлайн
gdzguru.com Видеорешения решебники- 1 класс
- Математика
- Английский язык
- Русский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
Готовые домашние задания по химии по классам
Также смотрите разделы связанные с разделом Готовые домашние задания по химии:
Ниже Вы можете бесплатно скачать электронные книги и учебники и читать статьи и уроки к разделу Готовые домашние задания по химии:
- Все домашние работы по химии, 8 класс, Новицкий А.
 Р., 2011, к учебнику по химии за 8 класс, Габриелян О.С.
Р., 2011, к учебнику по химии за 8 класс, Габриелян О.С. - Все домашние работы по химии, 8 класс, Новицкий А.Р., 2012, к учебнику по химии за 8 класс, Рудзитис Г.Е.
- ГДЗ по химии для 8 класса к «Учебник. Химия. 8 класс, Гузей Л.С., Сорокин В.В., Суровцева Р.П., 2000»
- ГДЗ по химии для 8 класса к «Химия. Учебник для 8 класса общеобразовательных учреждений, Габриелян О.С., 2001»
- ГДЗ по химии для 8-11 классов к «Задачник по химии для 8-11 классов, Гольдфарб С.И., Ходаков Ю.В., 2004»
- ГДЗ по химии для 8-9 классов к «Дидактические материалы по химии для 8-9 классов, Радецкий А.М., Горшкова В.П., 2000»
- ГДЗ по химии, 8 класс, 2013, к учебнику по химии за 8 класс, Габриелян О.С.
- ГДЗ по химии, 8 класс, к учебнику по химии за 8 класс, Минченков Е.Е.
- ГДЗ по химии. 8 класс. Новицкий А.Р. К учебнику по химии за 8 класс. Габриелян О.С. 2011
- ГДЗ по химии. 8 класс. Новицкий А.Р. К учебнику по химии за 8 класс. Рудзитис Г.Е. 2011
- Готовые домашние задания — Химия — 8-11 класс — К сборнику задач и упражнений — Хомченко И.
 Г.
Г. - Готовые домашние задания по химии — 8 класс — К учебнику Химия — 8 класс — Гузей Л.С., Сорокин В.В., Суровцева Р.П.
- Готовые домашние задания по химии — 8 класс — К учебнику Химия — 8 класс — Рудзитис Г.Е., Фельдман Ф.Г.
- Домашняя работа по химии, 8 класс, Сергеева О.Ю., 2013, к учебнику по химии за 8 класс, Габриелян О.С., 2011
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, Хомченко И.Г., 2010
- Все домашние работы по химии, 9 класс, Новицкий А.Р., 2011, к учебнику по химии за 9 класс, Габриелян О.С.
- ГДЗ по химии для 8-11 классов к «Задачник по химии для 8-11 классов, Гольдфарб С.И., Ходаков Ю.В., 2004»
- ГДЗ по химии для 8-9 классов к «Дидактические материалы по химии для 8-9 классов, Радецкий А.М., Горшкова В.П., 2000»
- ГДЗ по химии для 9 класса 2013 к «Химия.
 9 класс: учебник для общеобразовательных учреждений, Габриелян О.С., 2004, 2011»
9 класс: учебник для общеобразовательных учреждений, Габриелян О.С., 2004, 2011» - ГДЗ по химии для 9 класса к «Учебник. Химия. 9 класс, Рудзитис Г.Е., Фельдман Ф.Г., 1999»
- ГДЗ по химии для 9 класса к «Химия. Учебник для 9 класса общеобразовательных учреждений, Габриелян О.С., 2002»
- ГДЗ по химии для 9 класса к «Химия. Учебник. 9 класс, Габриелян О.С., 2011»
- ГДЗ по химии, 9 класс, 2015, к учебнику по химии за 9 класс, Габриелян О.С.
- ГДЗ по химии, 9 класс, 2015, к учебнику по химии за 9 класс, Рудзитис Г.Е., Фельдман Ф.Г.
- ГДЗ по химии. 9 класс. Новицкий А.Р. К учебнику по химии за 9 класс. Рудзитис Г.Е. 2011
- Готовые домашние задания — Химия — 8-11 класс — К сборнику задач и упражнений — Хомченко И.Г.
- Готовые домашние задания по химии — 9 класс — К учебнику Химия — 9 класс — Гузей Л.С., Сорокин В.В., Суровцева Р.П.
- Готовые домашние задания по химии — 9 класс — К учебнику Химия — 9 класс — Рудзитис Г.Е., Фельдман Ф.Г.
- Домашняя работа по химии, 9 класс, к учебнику по химии за 9 класс, Рудзитис Г.
 Е., Фельдман Ф.Г., 1999
Е., Фельдман Ф.Г., 1999 - Домашняя работа по химии, 9 класс, Шадрина М.С., Сбруева Е.А., 2013, к учебнику по химии за 9 класс, Габриелян О.С., 2011
- Проверь себя, Решебник к учебнику химия, 9 класс, Кондратьев В.И., 2010
- Промеряем домашние задания, Химия, 9 класс, Петров А.П., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, Хомченко И.Г., 2010
- ГДЗ по химии для 10 класса 2011 к «Химия. 10 класс. Базовый уровень: учебник для общеобразовательных учреждений, Габриелян О.С., 2010»
- ГДЗ по химии для 10 класса 2012 к «Химия. 10 класс. Базовый уровень: учебник для общеобразовательных учреждений, Габриелян О.С., 2010»
- ГДЗ по химии для 10 класса к «Дидактические материалы по химии для 10-11 классов: Пособие для учителя, Радецкий, Горшкова, Кругликова, 1999»
- ГДЗ по химии для 10 класса к «Учебник.
 Химия. 10 класс, Габриелян О.С., 2007»
Химия. 10 класс, Габриелян О.С., 2007» - ГДЗ по химии для 10 класса к «Учебник. Химия. 10 класс, Гузей Л.С., Суровцева Р.П., 1999»
- ГДЗ по химии для 10 класса к «Учебник. Химия. 10 класс, Рудзитис Г.Е., Фельдман Ф.Г., 2000»
- ГДЗ по химии для 10 класса к «Химия. 10 класс: Учебник для общеобразовательных учреждений, Габриелян, Маскаев, Пономарев, Теренин, 2002»
- ГДЗ по химии для 10-11 классов 2008 к «Органическая химия: учебник для учащихся 10-11 классов общеобразовательных учебных заведений, Цветков Л.А., 2006»
- ГДЗ по химии для 11 класса к «Дидактические материалы по химии для 10-11 классов: Пособие для учителя, Радецкий, Горшкова, Кругликова, Курьянова, 1999, 2001»
- ГДЗ по химии для 8-11 классов к «Задачник по химии для 8-11 классов, Гольдфарб С.И., Ходаков Ю.В., 2004»
- ГДЗ по химии, 10 класс, 2015, к учебнику по химии за 10 класс, Гузей Л.С., Суровцева Р.П.
- ГДЗ по химии, 10 класс, 2015, к учебнику по химии за 10 класс, Рудзитис Г.
 Е., Фельдман Ф.Г.
Е., Фельдман Ф.Г. - ГДЗ по химии, 10-11 класс, 2008, к учебнику по химии за 10-11 класс, Цветкова Л.А.
- Готовые домашние задания — Химия — 8-11 класс — К сборнику задач и упражнений — Хомченко И.Г.
- Готовые домашние задания по химии — 10 класс — К учебнику Химия — 10 класс — Гузей Л.С., Суровцева Р.П.
- Готовые домашние задания по химии — 10 класс — К учебнику Химия — 10 класс — Рудзитис Г.Е., Фельдман Ф.Г.
- Домашняя работа по химии, 10 класс, Сергеева О.Ю., 2012, к учебнику по химии за 10 класс, Габриелян О.С., 2010
- Подробный разбор заданий по химии, 10 класс, Горковенко М.Ю., 2007, к учебнику по химии за 10 класс, Габриелян О.С., Маскаев Ф.Н.
- Решебник по химии, 10 класс, Габриелян, 2002
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, Белавин И.Ю., 2005
- Решение задач по химии, Хомченко И.
 Г., 2010
Г., 2010
- ГДЗ по химии для 10 класса к «Дидактические материалы по химии для 10-11 классов: Пособие для учителя, Радецкий, Горшкова, Кругликова, 1999»
- ГДЗ по химии для 10-11 классов 2008 к «Органическая химия: учебник для учащихся 10-11 классов общеобразовательных учебных заведений, Цветков Л.А., 2006»
- ГДЗ по химии для 11 класса 2007 к «Химия. 11 класс: Учебник для общеобразовательных учреждений, Габриелян О.С., Лысова Г.Г., 2006»
- ГДЗ по химии для 11 класса 2013 к «Химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений, Габриелян О.С., 2011»
- ГДЗ по химии для 11 класса к «Дидактические материалы по химии для 10-11 классов: Пособие для учителя, Радецкий, Горшкова, Кругликова, Курьянова, 1999, 2001»
- ГДЗ по химии для 11 класса к «Учебник. Химия. 11 класс. Базовый уровень, Габриелян О.С.»
- ГДЗ по химии для 11 класса к «Химия. 11 класс: Учебник для общеобразовательных учреждений, Габриелян О.С., Лысова Г.
 Г., 2002»
Г., 2002» - ГДЗ по химии для 11 класса к «Химия. 11 класс: Учебник для общеобразовательных учреждений, Гузей Л.С., Суровцева Р.П., Лысова Г.Г., 2002»
- ГДЗ по химии для 8-11 классов к «Задачник по химии для 8-11 классов, Гольдфарб С.И., Ходаков Ю.В., 2004»
- ГДЗ по химии, 10-11 класс, 2008, к учебнику по химии за 10-11 класс, Цветкова Л.А.
- ГДЗ по химии, 11 класс, 2013, к учебнику по химии за 11 класс, Габриелян О.С.
- ГДЗ по химии, 11 класс, 2015, к учебнику по химии за 11 класс, Габриелян О.С.
- ГДЗ по химии, 11 класс, 2015, к учебнику по химии за 11 класс, Гузей Л.С.
- ГДЗ по химии, 11 класс, Кондратьев В.И., 2006, к учебнику по химии за 11 класс, Новошинский И.И., Новошинская Н.С.
- ГДЗ по химии, 11 класс, Кондратьев, 2006, к учебнику по химии за 11 класс, Новошинский, Новошинская
- Готовые домашние задания — Химия — 8-11 класс — К сборнику задач и упражнений — Хомченко И.Г.
- Готовые домашние задания по химии — 11 класс — К учебнику Химия — 11 класс — Габриелян О.
 С., Лысова Г.Г.
С., Лысова Г.Г. - Готовые домашние задания по химии — 11 класс — К учебнику Химия — 11 класс — Гузей Л.С., Суровцева Р.П., Лысова Г.Г.
- Готовые домашние задания по химии — 11 класс — К учебнику Химия — 11 класс — Рудзитис Г.Е., Фельдман Ф.Г.
- Домашняя работа по химии, 11 класс, Сергеева О.Ю., 2013, к учебнику по химии за 11 класс, Габриелян О.С., 2011
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, 8-11 класс, Хомченко И.Г., 2010
- Решение задач по химии, Белавин И.Ю., 2005
- Решение задач по химии, Хомченко И.Г., 2010
|
Класс |
Название урока |
Ссылка на учебные материалы |
|
10 |
Формирование органической химии как науки. |
https://resh.edu.ru/subject/lesson/6149/main/170400/ |
|
10 |
Алканы. Состав, строение, гомологический ряд, изомерия, номенклатура |
https://resh.edu.ru/subject/lesson/6151/main/150012/ |
|
10 |
Физические и химические свойства алканов (на примере метана и этана). Применение на основе свойств |
https://vk.com/video-130001791_456239025 |
|
10 |
Решение задач на нахождение молекулярной формулы газообразного углеводорода |
https://www. |
|
10 |
Алкены. Состав, строение, гомологический ряд, изомерия, номенклатура |
https://resh.edu.ru/subject/lesson/5412/main/212567/ |
|
10 |
Физические и химические свойства этилена. Применение на базе свойств. Полиэтилен |
https://resh.edu.ru/subject/lesson/5412/main/212567/ |
|
10 |
Синтетические полимеры. Конденсационные полимеры. Пенопласты |
https://resh.edu.ru/subject/lesson/6095/main/150826/ |
|
10 |
Алкины. |
|
|
10 |
Физические и химические свойства ацетилена. Применение на базе свойств. Поливинилхлорид |
|
|
10 |
Бензол: состав, строение, свойства, применение |
https://resh.edu.ru/subject/lesson/4775/main/150497/ |
|
10 |
Природные источники углеводородов. Состав нефти и продукты её переработки |
https://resh.edu.ru/subject/lesson/6148/main/170465/ |
|
10 |
Природный и попутный нефтяной газы, их состав и использование |
https://resh. |
|
10 |
Предельные одноатомные спирты. Состав, строение, изомерия, номенклатура. Физиологическое действие метанола и этанола на организм человека |
https://resh.edu.ru/subject/lesson/4769/main/150554/ |
|
10 |
Свойства метанола и этанола. Применение |
https://resh.edu.ru/subject/lesson/4769/main/150554/ |
|
10 |
Этиленгликоль и глицерин как представители предельных многоатомных спиртов |
|
|
10 |
Фенол: строение, свойства, применение |
https://resh. |
|
10 |
Метаналь и этаналь – представители предельных альдегидов |
https://resh.edu.ru/subject/lesson/4776/main/150608/ |
|
10 |
Уксусная кислота как представитель предельных одноосновных карбоновых кислот |
https://vk.com/video-130001791_456239031 |
|
10 |
Сложные эфиры и жиры. Мыла. Состав, строение, свойства, получение, применение |
https://resh.edu.ru/subject/lesson/5952/main/150635/ |
|
10 |
Углеводы. |
https://resh.edu.ru/subject/lesson/6150/main/150691/ |
|
10 |
Сахароза. Крахмал и целлюлоза. Искусственные волокна |
https://resh.edu.ru/subject/lesson/5413/main/150717/ |
|
10 |
Генетическая связь между классами органических соединений |
|
|
10 |
Натуральный каучук. Синтетические каучуки |
https://resh.edu.ru/subject/lesson/6152/main/150853/ |
|
10 |
Аминокислоты как амфотерные органические соединения |
https://resh. |
|
10 |
Белки. Состав, структуры белка. Химические свойства. Биохимические функции |
https://resh.edu.ru/subject/lesson/4743/main/150746/ |
|
10 |
Лекарства. Витамины |
https://resh.edu.ru/subject/lesson/5452/main/150815/ |
|
10 |
Гормоны. Ферменты |
https://www.youtube.com/ |
|
10 |
Азотосодержащие гетероциклические соединения. Нуклеиновые кислоты |
https://resh. |
|
10 |
Органическая химия, человек и природа |
https://resh.edu.ru/subject/lesson/4823/main/150937/ |
|
11 |
Современная модель строения атома. Электронная конфигурация атома |
https://resh.edu.ru/subject/lesson/6479/main/150993/ |
|
11 |
Законы сохранения массы и энергии в химии |
https://resh.edu.ru/subject/lesson/6479/main/150993/ |
|
11 |
Валентность и валентные возможности атомов |
https://resh. |
|
11 |
Пространственное строение молекул |
https://resh.edu.ru/subject/lesson/5911/main/151057/ |
|
11 |
Электронная природа химической связи. Ковалентная связь |
|
|
11 |
Ионная связь. Металлическая связь. Водородная связь |
|
|
11 |
Кристаллические и аморфные вещества. Кристаллические решётки. Причины многообразия веществ |
https://resh. |
|
11 |
Гомогенные и гетерогенные реакции. Скорость реакций, её зависимость от различных факторов |
|
|
11 |
Обратимость реакций. Химическое равновесие и его смещение под действием различных факторов |
|
|
11 |
Дисперсные системы |
https://resh.edu.ru/subject/lesson/4939/main/151137/ |
|
11 |
Электролитическая диссоциация. |
https://www.youtube.com/ |
|
11 |
Реакции в растворах электролитов |
|
|
11 |
рН раствора. Гидролиз солей |
https://resh.edu.ru/subject/lesson/5912/main/92794/ |
|
11 |
Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов |
|
|
11 |
Принципы химического производства. |
https://resh.edu.ru/subject/lesson/3514/main/151433/ |
|
11 |
Обзор металлических элементов А- и В- групп |
https://resh.edu.ru/subject/lesson/5814/main/151240/ |
|
11 |
Общая характеристика и способы получения металлов |
https://resh.edu.ru/subject/lesson/3493/main/151216/ |
|
11 |
Медь. Цинк. Титан. Хром |
https://resh.edu.ru/subject/lesson/3534/main/151269/ |
|
11 |
Сплавы металлов |
https://resh. |
|
11 |
Коррозия металлов |
https://resh.edu.ru/subject/lesson/3479/main/151190/ |
|
11 |
Неметаллы. Общая характеристика |
https://resh.edu.ru/subject/lesson/5939/main/151324/ |
|
11 |
Химические свойства неметаллов |
https://resh.edu.ru/subject/lesson/5939/main/151324/ |
|
11 |
Электролиз растворов и расплавов солей. Применение электролиза |
https://resh. |
|
11 |
Классификация химических реакций |
https://resh.edu.ru/subject/lesson/4938/main/151110/ |
|
11 |
Свойства оксидов неметаллов. Свойства серной и азотной кислот. Водородные соединения металлов |
https://resh.edu.ru/subject/lesson/5913/main/151350/ |
|
11 |
Правила безопасной работы с химическими веществами, средствами бытовой химии |
https://resh.edu.ru/subject/lesson/3504/main/151489/ |
|
11 |
Моющие и чистящие средства. |
https://resh.edu.ru/subject/lesson/3504/main/151489/ |
|
11 |
Химическое загрязнение окружающей среды и его последствия. Охрана гидросферы, почвы, атмосферы, флоры и фауны от химического загрязнения |
https://resh.edu.ru/subject/lesson/3504/main/151489/ |
|
11 |
Генетическая связь неорганических и органических веществ |
https://resh.edu.ru/subject/lesson/4960/main/151378/ |
NCERT для класса 11 по естествознанию, химия Глава 1
Лист № 272:
Вопрос 8. 1:
1:
Присвойте степени окисления подчеркнутым элементам каждого из следующих видов:
(а) NaH 2 P O 4 (б) NaH S O 4 (в) H 4 P 2 O 7 (г) K 2 Mn O 4
(д) Ca O 2 (е) Na B H 4 (г) H 2 S 2 O 7 (ч) KAl ( S O 4 ) 2 .12 ч 2 O
Ответ:
(а)
Пусть степень окисления P составляет x .
ср знаю это,
Окисление количество Na = +1
Окисление количество H = +1
Окисление количество O = –2
Тогда, у нас
Следовательно, степень окисления P составляет +5.
б)
Тогда, у нас есть
Следовательно,
степень окисления S составляет +6.
(в)
Тогда, у нас есть
Следовательно, степень окисления P + 5.
(г)
Тогда, у нас есть
Следовательно, степень окисления Mn + 6.
д)
Тогда, у нас есть
Следовательно, степень окисления O — 1.
(ж)
Тогда, у нас есть
Следовательно, степень окисления B + 3.
(г)
Тогда, у нас есть
Следовательно, степень окисления S + 6.
(в)
Тогда, у нас есть
Или,
ср может игнорировать молекулу воды, поскольку это нейтральная молекула. Затем сумма степеней окисления всех атомов молекулы воды может принимать равным нулю. Поэтому, игнорируя молекулу воды, мы иметь
Следовательно, степень окисления S составляет +6.
Лист № 272:
Вопрос 8. 2:
2:
Каковы степени окисления подчеркнутых элементов в каждом из следующих пунктов и как вы рационализируете свои результаты?
(а) K I 3 (б) H 2 S 4 O 6 (в) Fe 3 O 4 (г) C H 3 C H 2 OH (e) C H 3 C OOH
Ответ:
(а) К I 3
В КИ 3 степень окисления (О.N.) K равно +1. Следовательно, средняя степень окисления I составляет. Однако О. не может быть дробным. Следовательно, нам нужно будет рассмотреть структуру KI 3 , чтобы найти степени окисления.
В молекуле KI 3 атом йода образует координационную ковалентную связь с молекулой йода.
Следовательно, в молекуле KI 3 O.N. двух атомов I, образующих молекулу I 2 , равно 0, тогда как O. N. атома I, образующего координатную связь, составляет –1.
N. атома I, образующего координатную связь, составляет –1.
(б) H 2 S 4 O 6
Однако О. не может быть дробным. Следовательно, S должен присутствовать в молекуле в разных степенях окисления.
Компания O.N. двух из четырех атомов S составляет +5 и О.Н. двух других атомов S составляет 0.
(в)
При приеме О. O как –2, O.N. Fe оказывается. Однако О. не может быть дробным.
Здесь один из трех атомов Fe демонстрирует O.N. of +2 и два других атома Fe демонстрируют O.N. +3.
(г)
2 ( x ) + 6 (+1) + 1 (-2) = 0
или, 2 x + 4 = 0
или, x = -2
Следовательно, O.N. C равно –2.
(д)
2 ( x ) + 4 (+1) + 2 (-2) = 0
или, 2 x = 0
или, x = 0
Однако 0 — средний О. N. of C. Два атома углерода, присутствующие в этой молекуле, находятся в разных средах. Следовательно, они не могут иметь одинаковую степень окисления. Таким образом, C проявляет степени окисления +2 и –2 в CH 3 COOH.
N. of C. Два атома углерода, присутствующие в этой молекуле, находятся в разных средах. Следовательно, они не могут иметь одинаковую степень окисления. Таким образом, C проявляет степени окисления +2 и –2 в CH 3 COOH.
Лист № 272:
Вопрос 8.3:
Обосновать, что следующие реакции являются окислительно-восстановительными реакциями:
(а) CuO (тв) + H 2 (г) → Cu (тв) + H 2 O (г)
(б) Fe 2 O 3 (т) + 3CO (г) → 2Fe (т) + 3CO 2 (г)
(в) 4BCl 3 (г) + 3LiAlH 4 (с) → 2B 2 H 6 (г) + 3LiCl (с) + 3 AlCl 3 (с)
(г) 2K (с) + F 2 (г) → 2K + F– (с)
(д) 4 NH 3 (г) + 5 O 2 (г) → 4NO (г) + 6H 2 O (г)
Ответ:
(а)
Пусть запишем степень окисления каждого элемента, входящего в данный реакция как:
Здесь,
степень окисления Cu снижается с +2 в CuO до 0 в Cu i. е.,
CuO восстанавливается до Cu. Кроме того, степень окисления H увеличивается от
От 0 дюймов H 2 до +1 дюймов H 2 O, т. Е. H 2 — это
окисляется до H 2 O. Следовательно, эта реакция является окислительно-восстановительной.
е.,
CuO восстанавливается до Cu. Кроме того, степень окисления H увеличивается от
От 0 дюймов H 2 до +1 дюймов H 2 O, т. Е. H 2 — это
окисляется до H 2 O. Следовательно, эта реакция является окислительно-восстановительной.
б)
Напишем степень окисления каждого элемента в данной реакции:
Здесь степень окисления Fe уменьшается с +3 в Fe 2 O 3 до 0 в Fe i.е., Fe 2 O 3 восстанавливается до Fe. На С другой стороны, степень окисления C увеличивается с +2 в CO до +4 в CO 2 , т.е. CO окисляется до CO 2 . Следовательно данная реакция является окислительно-восстановительной реакцией.
(в)
степень окисления каждого элемента в данной реакции может быть представлено как:
В
В этой реакции степень окисления B снижается с +3 в BCl 3 до –3 в B 2 H 6 . т.е. BCl 3 — это
уменьшено до B 2 H 6 . Кроме того, степень окисления
H увеличивается с -1 в LiAlH 4 до +1 в B 2 H 6 то есть LiAlH 4 окисляется до B 2 H 6 .
Следовательно, данная реакция является окислительно-восстановительной.
т.е. BCl 3 — это
уменьшено до B 2 H 6 . Кроме того, степень окисления
H увеличивается с -1 в LiAlH 4 до +1 в B 2 H 6 то есть LiAlH 4 окисляется до B 2 H 6 .
Следовательно, данная реакция является окислительно-восстановительной.
(г)
степень окисления каждого элемента в данной реакции может быть представлено как:
В В этой реакции степень окисления K увеличивается от 0 в K до +1. в KF i.е., K окисляется до KF. С другой стороны, окисление количество F уменьшается с 0 в F 2 до –1 в KF, т.е. F 2 сокращается до KF.
Следовательно, Вышеупомянутая реакция представляет собой окислительно-восстановительную реакцию.
д)
Степень окисления каждого элемента в данной реакции может быть представлено как:
Здесь степень окисления N увеличивается с –3 в NH 3 до +2 в NO. С другой стороны, степень окисления O 2 уменьшается с 0 в O 2 до –2 в NO и H 2 O
то есть O 2 уменьшается. Следовательно, данная реакция является окислительно-восстановительной.
реакция.
С другой стороны, степень окисления O 2 уменьшается с 0 в O 2 до –2 в NO и H 2 O
то есть O 2 уменьшается. Следовательно, данная реакция является окислительно-восстановительной.
реакция.
Лист № 272:
Вопрос 8.4:
Фтор реагирует со льдом и приводит к изменению:
H 2 O (т) + F 2 (г) → HF (г) + HOF (г)
Обоснуйте, что эта реакция является окислительно-восстановительной реакцией.
Ответ:
Напишем степень окисления каждого атома, участвующего в указанной выше реакции его символ:
Здесь мы наблюдали
что степень окисления F увеличивается с 0 в F 2 до
+1 в HOF. Кроме того, степень окисления снижается с 0 в F 2 до
–1 в HF. Таким образом, в указанной выше реакции F как окисляется, так и
уменьшено. Следовательно, данная реакция является окислительно-восстановительной.
Следовательно, данная реакция является окислительно-восстановительной.
Лист № 272:
Вопрос 8.5:
Рассчитайте степень окисления серы, хрома и азота в H 2 SO 5 , -. Предложите структуру этих соединений. Считайте заблуждение.
Ответ:
(i)
Однако О. of S не может быть +8. S имеет шесть валентных электронов.Следовательно, О. of S не может быть больше +6.
структура H 2 SO 5 отображается следующим образом:
Следовательно, О. S составляет +6.
(ii)
Здесь, нет никакой ошибки в O.N. Cr дюйм.
структура является показано следующим образом:
Здесь каждый из двух атомов Cr демонстрирует O.№ +6.
(iii)
Здесь,
нет никакой ошибки в O. N. от N дюйм
N. от N дюйм
структура является показано следующим образом:
Атом N демонстрирует O.N. из +5.
Лист № 272:
Вопрос 8.6:
Напишите формулы для следующих соединений:
(a) Хлорид ртути (II) (b) Сульфат никеля (II)
(c) Оксид олова (IV) (d) Сульфат таллия (I)
(e) Сульфат железа (III) (f) Оксид хрома (III)
Ответ:
(а) Меркурий (II) хлорид:
HgCl 2
(б) Никель (II) сульфат:
NiSO 4
(в) Олово (IV) оксид:
SnO 2
(г) Таллий (I) сульфат:
Tl 2 SO 4
(e) Железо (III) сульфат:
Fe 2 (SO 4 ) 3
(ж) Хром (III) оксид:
Cr 2 O 3
Лист № 272:
Вопрос 8. 7:
7:
Предложите список веществ, в которых углерод может иметь степень окисления от –4 до +4, а азот — от –3 до +5.
Ответ:
вещества, в которых углерод может проявлять степень окисления от –4 до +4 перечислены в следующей таблице.
Вещество | О.Н. углерода |
CH 2 Класс 2 | 0 |
ClC≡CCl | +1 |
HC≡CH | –1 |
CHCl 3 , CO | +2 |
CH 3 Класс | –2 |
Класс 3 C — CCl 3 | +3 |
H 3 C — CH 3 | –3 |
CCl 4 , CO 2 | +4 |
СН 4 | –4 |
вещества, в которых азот может проявлять степень окисления от –3
до +5 перечислены в следующей таблице.
Вещество | О.Н. азота |
N 2 | 0 |
N 2 O | +1 |
N 2 H 2 | –1 |
НЕТ | +2 |
N 2 H 4 | –2 |
N 2 O 3 | +3 |
NH 3 | –3 |
НЕТ 2 | +4 |
N 2 O 5 | +5 |
Лист № 272:
Вопрос 8. 8:
8:
Хотя диоксид серы и перекись водорода могут действовать как окислители, так и восстановители в своих реакциях, озон и азотная кислота действуют только как окислители. Почему?
Ответ:
В диоксид серы (SO 2 ), степень окисления (O.N.) S составляет +4, а диапазон O.N. тот S может иметь значение от +6 до –2.
Следовательно, SO 2 может действовать как окислитель, а также как восстановитель.
В перекись водорода (H 2 O 2 ), О. O равен –1, а диапазон O.N. что O может иметь составляет от 0 до –2. O может иногда также достигать окисления числа +1 и +2. Следовательно, H 2 O 2 может действовать как окислитель, а также как восстановитель.
В
озон (O 3 ),
О. O равен нулю, а диапазон O.N. что O может иметь
от 0 до –2. Таким образом, компания O.N. O может уменьшаться только в
Это дело. Следовательно, O 3 действует только как окислитель.
Следовательно, O 3 действует только как окислитель.
В азотная кислота (HNO 3 ), О. of N равно +5, а диапазон O.N. что N может иметь От +5 до –3. Таким образом, компания O.N. из N может только уменьшаться в этом дело. Следовательно, HNO 3 действует только как окислитель.
Лист № 272:
Вопрос 8.9:
Рассмотреть реакции:
(а) 6 CO 2 (г) + 6H 2 O (л) → С 6 H 12 О 6 (водн.) + 6O 2 (г)
(б) О 3 (г) + H 2 O 2 (л) → H 2 O (л) + 2O 2 (г)
Почему эти реакции более уместно записывать как:
(а) 6CO 2 (г) + 12H 2 O (л) → С 6 H 12 О 6 (водн.) + 6H 2 O (л) + 6O 2 (г)
(б) О 3 (г) + H 2 O 2 (л) → H 2 O (л) + O 2 (г) + O 2 (г)
Также Предложите методику исследования пути вышеперечисленных (а) и (б) редокс
реакций.
Ответ:
(а) г. Процесс фотосинтеза состоит из двух этапов.
Шаг 1:
H 2 O разлагается, давая H 2 и О 2 .
Шаг 2:
H 2 произведено в шаге 1 снижает CO 2 , тем самым производя глюкозу (C 6 H 12 O 6 ) и H 2 O.
Сейчас, дана чистая реакция процесса как:
Это более уместно написать реакцию, как указано выше, потому что Молекулы воды также образуются в процессе фотосинтеза.
Путь этой реакции можно исследовать, используя радиоактивный H 2 O 18 вместо H 2 O.
б) О 2 производится из каждого из двух реагентов O 3 и H 2 O 2 .По этой причине О 2 написано дважды.
Данная реакция включает два этапа. Первый, О 3 разлагается на O 2 и O. На втором этапе H 2 O 2 реагирует с O, полученным на первой стадии, с образованием H 2 O и О 2 .
путь этой реакции можно исследовать, используя или же .
Стр. № 273:
Вопрос 8.10:
Состав AgF 2 нестабильное соединение. Однако в случае образования соединение действует как очень сильный окислитель. Почему?
Ответ:
Степень окисления
Ag в AgF 2 равно +2. Но +2 — это нестабильная степень окисления.
Ag. Следовательно, всякий раз, когда образуется AgF 2 , серебро легко
принимает электрон с образованием Ag + . Это помогает принести
степень окисления Ag снизилась с +2 до более стабильного состояния +1. Как
В результате AgF 2 действует как очень сильный окислитель.
Как
В результате AgF 2 действует как очень сильный окислитель.
Стр. № 273:
Вопрос 8.11:
Всегда реакция между окислителем и восстановителем осуществляется вне, соединение с более низкой степенью окисления образуется, если восстанавливающий агента в избытке, и образуется соединение с более высокой степенью окисления если окислитель в избытке.Обоснуйте это заявление, давая три иллюстрации.
Ответ:
Всегда реакция между окислителем и восстановителем осуществляется вне, соединение с более низкой степенью окисления образуется, если восстанавливающий агента в избытке, и образуется соединение с более высокой степенью окисления если окислитель в избытке. Это можно проиллюстрировать как следует:
(i) П 4 и F 2 являются восстановителем и окислителем соответственно.
Если превышение P 4 лечится F 2 , затем ПФ 3 будет производиться, в котором степень окисления (О.Н.) P равна +3.
Однако если P 4 лечится с превышением F 2 , затем ПФ 5 будет производиться, при этом O.N. P составляет +5.
(ii) К действует как восстановитель, тогда как O 2 окислитель.
Если избыток К реагирует с О 2 , затем K 2 O будет сформирован, при этом O.N. O составляет –2.
Однако если K реагирует с избытком O 2 , затем K 2 O 2 будет сформирован, при этом O.N. O равно –1.
(iii) C является восстановителем, а O 2 действует как окислитель.
Если избыток C сжигается при недостаточном количестве O 2, , тогда будет производиться CO, при этом О.N. of C равно +2.
Вкл. с другой стороны, если C сжигается сверх O 2 ,
затем CO 2 будет производиться, при этом O.N. из C составляет +4.
с другой стороны, если C сжигается сверх O 2 ,
затем CO 2 будет производиться, при этом O.N. из C составляет +4.
Стр. № 273:
Вопрос 8.12:
Как вы рассчитываете на следующие наблюдения?
(a) Хотя и щелочной перманганат калия, и кислый перманганат калия используются в качестве окислителей, тем не менее, при производстве бензойной кислоты из толуола мы используем спиртовой перманганат калия в качестве окислителя.Почему? Напишите сбалансированное окислительно-восстановительное уравнение реакции.
(b) Когда концентрированная серная кислота добавляется к неорганической смеси, содержащей хлорид, мы получаем бесцветный газ HCl с резким запахом, но если смесь содержит бромид, мы получаем красный пар брома. Почему?
Ответ:
(a) При производстве бензойной кислоты из толуола спиртовой перманганат калия используется в качестве окислителя по следующим причинам.
(i) В нейтральной среде ионы OH — образуются в самой реакции. В результате можно снизить стоимость добавления кислоты или основания.
(ii) KMnO 4 и спирт однородны по отношению друг к другу, поскольку оба полярны. Толуол и спирт также гомогенны друг другу, потому что оба являются органическими соединениями. В гомогенной среде реакции могут протекать быстрее, чем в гетерогенной. Следовательно, в спирте KMnO 4 и толуол могут реагировать с большей скоростью.
Сбалансированное окислительно-восстановительное уравнение реакции в нейтральной среде имеет следующий вид:
(б) При конц. H 2 SO 4 добавляется к неорганической смеси, содержащей бромид, первоначально образуется HBr. HBr, являясь сильным восстановителем, восстанавливает H 2 SO 4 до SO 2 с выделением красных паров брома.
Но, когда конц. H 2 SO 4 добавляется к неорганической смеси, содержащей хлорид, при этом выделяется резкий пахнущий газ (HCl).HCl, являясь слабым восстановителем, не может восстановить H 2 SO 4 до SO 2 .
H 2 SO 4 добавляется к неорганической смеси, содержащей хлорид, при этом выделяется резкий пахнущий газ (HCl).HCl, являясь слабым восстановителем, не может восстановить H 2 SO 4 до SO 2 .
Стр. № 273:
Вопрос 8.13:
Определить окисленное вещество, восстановленный, окислитель и восстановитель для каждого из следующих реакции:
(а) 2AgBr (ы) + C 6 H 6 O 2 (водн.) → 2Ag (с) + 2HBr (водн.) + C 6 H 4 O 2 (водн.)
(б) HCHO (л) + 2 [Ag (NH 3 ) 2 ] + (водн.) + 3OH — (водн.) → 2Ag (с) + HCOO — (водн.) + 4NH 3 (водн.) + 2H 2 O (л)
(в) HCHO (l) + 2Cu 2+ ( водн.) + 5 OH — (водн.) → Cu 2 O (т) + HCOO — (водн.) + 3H 2 O (л)
(г) N 2 H 4 (л) + 2H 2 O 2 (л) → N 2 (г) + 4H 2 O (л)
(е) Pb (т) + PbO 2 (т) + 2H 2 SO 4 (водн.) → 2ПбСО 4 (т) + 2H 2 O (л)
Ответ:
(а) Окисленный вещество → С 6 H 6 O 2
Сниженный вещество → AgBr
Окисление агент → AgBr
Редукционный агент → С 6 H 6 O 2
(б) Окисленный вещество → HCHO
Сниженный вещество →
Окисление агент →
Редукционный агент → HCHO
(в) Окисленный вещество → HCHO
Сниженный вещество → Cu 2+
Окисление агент → Cu 2+
Редукционный агент → HCHO
(г) Окисленный вещество → № 2 H 4
Сниженный вещество → H 2 O 2
Окисление агент → H 2 O 2
Редукционный агент → № 2 H 4
(д) Окисленный вещество → Пб
Сниженный вещество → Пбо 2
Окисление агент → Пбо 2
Редукционный агент → Пб
Стр. № 273:
Вопрос 8.14:
Рассмотрим реакции:
(водн.) + I 2 (с) → (водн.) + 2I — (водн.)
водн.) + 2Br 2 (л) + 5 H 2 O (л) → (водн.) + 4Br — (водн.) + 10H + (водн.)
Почему один и тот же восстановитель, тиосульфат, по-разному реагирует с йодом и бромом?
Стр. № 273:
Вопрос 8.15:
Обоснуйте приведенные реакции, согласно которым среди галогенов фтор является лучшим окислителем, а среди галогеноводородных соединений лучшим восстановителем является иодистоводородная кислота.
Ответ:
F 2 банка окислить Cl — до Cl 2 , Br — до Br 2, и I — до I 2 как:
С другой стороны, Cl 2 ,
Br 2 и I 2 не окисляются F — на номер F 2 . Окислительная способность галогенов увеличивается в
порядок I 2
2
HI и HBr могут снизить H 2 SO 4 до SO 2 , но HCl и HF не могут. Следовательно, HI и HBr являются более сильными восстановителями, чем HCl и HF.
Решения NCERT для химии 11 класса в формате PDF на 2020-2021 годы.
ГЛАВА 1: НЕКОТОРЫЕ ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
ГЛАВА 2: СТРУКТУРА АТОМА
ГЛАВА 3: КЛАССИФИКАЦИЯ ЭЛЕМЕНТОВ И ПЕРИОДИЧНОСТЬ СВОЙСТВ
ГЛАВА 4: ХИМИЧЕСКАЯ СТРУКТУРА
И СТРУКТУРА ТВЕРДОЕ СОСТОЯНИЕСостояния материи
Твердые состояния
ГЛАВА 6: ТЕРМОДИНАМИКА
ГЛАВА 7: РАВНОВЕСИЕ
ГЛАВА 8: РЕАКЦИИ ПЕРЕРАБОТКИ
ГЛАВА 9: ВОДОРОД
ГЛАВА 9: ВОДОРОД
— ЭЛЕМЕНТЫГЛАВА 11: P — ЭЛЕМЕНТЫ БЛОКА
P — Элементы блока — I
P — Элементы блока — II
ГЛАВА 12: ОРГАНИЧЕСКАЯ ХИМИЯ — НЕКОТОРЫЕ БАЗОВЫЕ ПРИНЦИПЫ И ТЕХНИКИ
ГЛАВА 13: HONCYD
ГЛАВА 14: ХИМИЯ ОКРУЖАЮЩЕЙ СРЕДЫОтрасль науки, в рамках которой строение материи, ее свойства, использование и взаимодействие с другими изучаются типы материи и различные формы энергии называется химией.
1. С тех пор, как человек пришел на землю, бессмертный, его любознательная натура умоляла его постоянно делать новые открытия. В Харапских цивилизациях долины Инда (500–600 до н.э.) были разработаны методы металлургии для изготовления изделий из меди и бронзы. В египетской цивилизации методы сохранения трупов в виде «мумий» и химические вещества, используемые для этого, остаются загадкой. Даже сегодня мы не знаем о химических веществах, используемых для консервации трупов. Египтяне умели делать мыло, красители, стекло и т. Д.Пирамиды Египта — примеры их прогресса. Химики Египта работали над открытием сенсорного камня, универсального растворителя и зелья жизни. Хотя их попытки не увенчались успехом, но в процессе они узнали о таких процессах, как испарение, дистилляция и сублимация, которые помогают даже сегодня.
2. Для лечения были разработаны различные системы медицины: аллопатия в Европе, унани в Греции и китайская в Китае. В этом контексте Бодхаян Баанбхатта, Варах Михир, Арья Бхатта, Нагарджун, Чарак, Гарги, Катьяян и т. Д.внес значительный вклад. Мудрец Канад назвал мельчайшие частицы материей / элементами. Исходя из этого, Джон Далтон, учитель из Манчестера (Англия), дал свою теорию атома в 1808 году нашей эры.
Концепция «Панч Татва» (пять элементов) — это вклад только индийских философов. Например:
क्षिति जल पावक गगन समीरा
पंच रचित अति अधम सरीरा — रामचरित मानस (किष्किंधा कांड)
3. Древние индейцы обладали знаниями в области металлургии, ферментации и приготовления основ, экстрактов и дистиллятов.Полировка «Железного столба» Мехраули в Дели является предметом исследования, поскольку до настоящего времени на нем не было ржавчины.
Загрузите книги и офлайн-приложения NCERT 2020–21 на основе новой программы CBSE. Задайте свои сомнения относительно NIOS или UP Board, MP Board или других советов и поделитесь своими знаниями с друзьями и другими пользователями через дискуссионный форум.
Решения NCERT для химии 11 класса в формате PDF на 2020-2021 годы CBSE & UP
Решения NCERT для химии 11 класса в формате PDF для бесплатной загрузки.Решения NCERT по другим предметам на основе последней учебной программы CBSE на 2020-2021 годы также доступны для бесплатной загрузки. Наряду с солями NCERT, книгами для пересмотра, заданиями — решенными и нерешенными, примечаниями и специальными примечаниями для предстоящих экзаменов CBSE на 2020-2021 годы.
Решения NCERT для химии 11 класса
- Глава 1: Некоторые основные понятия химии
- Глава 2: Структура атома
- Глава 3: Классификация элементов и периодичность в свойствах
- Глава 4: Химическая связь и молекулярная структура
- Глава 5: Состояния материи
- Глава 6: Термодинамика
- Глава 7: Равновесие
- Глава 8: Редокс-реакции
- Глава 9: Водород
- Глава 10: Элементы блока
- Глава 11: Элементы блока p
- Глава 12: Органическая химия — некоторые основные принципы и методы
- Глава 13: Углеводороды
- Глава 14: Химия окружающей среды
Закон химического соединения
При химической реакции двух или более веществ образуется соединение.Следующие законы регулируют образование химических соединений:
Закон сохранения массы: «Материя не может быть создана или уничтожена». Этот закон был предложен Антуаном Лавуазье в 1789 году. Этот закон лег в основу нескольких более поздних разработок в химии. Фактически это был результат запланированных экспериментов, проведенных Лавуазье.
Атомная теория Дальтона : Мы знаем, что атомная теория Дальтона может объяснить законы химического сочетания.По словам Джона Далтона (1776 — 1884), «Материя состоит из маленьких неделимых частиц». Эти мельчайшие неделимые частицы называются атомами. Атомная теория Далтона помогает понять химические реакции, но в его время фундаментальные частицы атома, такие как протон, электрон и нейтрон, не были открыты.
Закон постоянной пропорции : «Данное соединение всегда содержит точно такую же пропорцию элементов по весу». Джозеф Пруст (1754–1826) заметил, что образцы карбоната меди, полученные естественным путем и полученные синтетическим путем в лаборатории, имеют одинаковый процентный состав элементов.
Закон множественной пропорции : Этот закон был предложен Дальтоном в 1803 году. Если два элемента могут объединяться, чтобы образовать более одного соединения, масса одного элемента, который объединяется с фиксированной массой другого элемента, находится в соотношении маленькое целое число.
Закон объединения весов : Согласно этому закону, массы двух элементов, которые по отдельности химически реагируют с идентичными массами третьего элемента, также являются массами, которые реагируют друг с другом и являются простыми кратными объединенному весу элемента, который либо равным его атомному весу, либо простым кратным ему.
Решения NCERT для класса 11 (все предметы)
NCERT Class 11 Solutions Organic Chemistry
NCERT Class 11 Solutions Organic Chemistry — Решения NCERT, подготовленные для студентов CBSE лучшими преподавателями в Дели.
Глава 12 — Органическая химия Некоторые основные принципы и методы
Химия класса XI
Вопрос 12.5: Что из следующего представляет правильное название IUPAC для рассматриваемых соединений? (a) 2,2-диметилпентан или 2-диметилпентан (b) 2,4,7-триметилоктан или 2,5,7-триметилоктан (c) 2-хлор-4-метилпентан или 4-хлор-2-метилпентан (d ) Бут-3-ин-1-ол или Бут-4-ол-1-ин
Ответ:
(a) Префикс di в названии ИЮПАК указывает на то, что в родительском элементе присутствуют две идентичные группы заместителей. цепь.Поскольку две метильные группы присутствуют в C – 2 родительской цепи данного соединения, правильное IPUAC-название данного соединения — 2, 2-диметилпентан.
(b) Локант номер 2, 4, 7 ниже, чем 2, 5, 7. Следовательно, название данного соединения по ИЮПАК — 2, 4, 7-триметилоктан.
(c) Если заместители присутствуют в эквивалентном положении родительской цепи, то меньший номер присваивается тому, который идет первым в названии, в соответствии с алфавитным порядком. Следовательно, правильное название данного соединения по ИЮПАК — 2-хлор-4-метилпентан.
(d) В данном соединении присутствуют две функциональные группы — спиртовая и алкиновая. Основная функциональная группа — это алкогольная группа. Следовательно, родительская цепочка будет иметь суффикс ol. Алкинская группа присутствует в C – 3 материнской цепи. Следовательно, правильное название данного соединения по ИЮПАК — But – 3 – yn – 1 – ol.
Вопрос 12.6: Нарисуйте формулы для первых пяти членов каждой гомологической серии, начиная со следующих соединений. (a) H – COOH (b) Ch4COCh4 (c) H – CH = Ch3
Ответ: Первые пять членов каждого гомологического ряда, начинающегося с данных соединений, показаны следующим образом:
(a)
H – COOH: метановая кислота
Ch4 – COOH: этановая кислота
Ch4 – Ch3 – COOH: пропановая кислота
Ch4 – Ch3 – Ch3 – COOH: бутановая кислота
Ch4 – Ch3 – Ch3 – Ch3 – COOH: пентановая кислота
(б)
Ch4COCh4: пропанон
Ch4COCh3Ch4: бутанон
Ch4COCh3Ch3Ch4: пентан-2-он
Ch4COCh3Ch3Ch3Ch4: гексан-2-
Ch4COCh3Ch3Ch3Ch3Ch4: гептан-2-
(с)
H – CH = Ch3: Ethene
Ch4 – CH = Ch3: Propene
Ch4 – Ch3 – CH = Ch3: 1-бутен
Ch4 – Ch3 – Ch3 – CH = Ch3: 1-Pentene
Ch4 –Ch3 – Ch3 – Ch3 – CH = Ch3: 1-Hexene
Для получения дополнительных учебных материалов по химии щелкните здесь — примечания к классу 11 состояний вещества pdf.
Вопрос 12.7: Приведите структурные формулы конденсированных и связанных линий и укажите присутствующие функциональные группы, если таковые имеются, для:
(a) 2,2,4-триметилпентан
(b) 2-гидрокси -1,2,3-пропантрикарбоновая кислота
(c) Гександиал
Вопрос 12.9: Что из двух: O2NCh3Ch3O– или Ch4Ch3O– будет более стабильным и почему?
Ответ: Группа NO2 — электроноакцепторная группа. Следовательно, он показывает –I эффект.Отводя к себе электроны, группа NO2 уменьшает отрицательный заряд соединения, тем самым стабилизируя его. С другой стороны, этильная группа представляет собой группу, высвобождающую электроны. Следовательно, этильная группа проявляет + I эффект. Это увеличивает отрицательный заряд соединения, тем самым дестабилизируя его. Следовательно, ожидается, что O2NCh3Ch3O– будет более стабильным, чем Ch4Ch3O–.
Вопрос 12.10: Объясните, почему алкильные группы действуют как доноры электронов при присоединении к π-системе.
Ответ Когда алкильная группа присоединена к π-системе, она действует как электронодонорная группа в процессе гиперконъюгации.Чтобы лучше понять эту концепцию, давайте возьмем пример пропена.
Студенты должны бесплатно загрузить решения NCERT и получить более высокие оценки на экзаменах. Группа учителей Studiestoday.com рекомендует студентам практиковать вопросы в книгах NCERT и загружать решения NCERT.
Решения NCERT для химии класса 11
Решения NCERT для химии класса 11 доступны здесь для бесплатной загрузки в формате PDF. Ознакомьтесь с лучшими решениями NCERT, чтобы получить высокие баллы на экзаменах.
Решения NCERT по химии 11 класса
РешенияNCERT для класса 11 по химии помогают понять сложные темы и определить ваши сильные и слабые стороны, что очень важно не только с точки зрения экзамена, но и закладывает хорошую основу для ваших будущих исследований.
Здесь мы предоставляем решения NCERT для всех глав химии класса 11. Все решения объясняются предметными экспертами, чтобы предоставить точный и исчерпывающий учебный материал для учащихся 11 класса.
Загрузите решения NCERT для химии класса 11 по главам по приведенным ниже ссылкам:
Примечание — Перед тем, как решать все вопросы, учащиеся должны знать последнюю программу CBSE по химии класса 11. Совет удалил многие темы из старой программы химии на текущий учебный год. Таким образом, студенты должны знать об удаленной части учебной программы, чтобы продолжить обучение эффективным и продуктивным образом.
Студенты, у которых возникли проблемы с решением сложных задач в книге NCERT по химии 11 класса, могут обратиться к решениям NCERT, представленным здесь. Решения NCERT по химии 11 класса были представлены в хорошо структурированном формате, чтобы дать четкое представление о концепциях и методах, подразумеваемых в каждом решении. Решение вопросов NCERT в соответствии с критериями, использованными в решениях NCERT, приведенных выше, обеспечит выдающиеся результаты на ежегодных экзаменах.
Также проверьте: Программа CBSE Class 11 2020-21 для всех предметов (пересмотренная)
Следуйте инструкциям NCERT для успешной сдачи школьных / конкурсных экзаменов
Как правило, студентам рекомендуется читать книги NCERT при подготовке к экзаменам совета директоров или любым конкурсным / вступительным экзаменам.Большинство вопросов на школьных и конкурсных экзаменах основаны на задачах с упражнениями, приведенных в Книгах NCERT.
КнигиNCERT наиболее известны тем, что объясняют концепции самым простым способом для легкого понимания, что помогает студентам укрепить основы и основы определенной темы. Это позволяет учащимся достаточно эффективно решать различные задачи, связанные с данной темой.
Также скачать:
Скачать бесплатные решения NCERT для химии 11 класса
Решения NCERT для химии 11 класса PDF: Ищете бесплатные решения NCERT для изучения химии 11 класса? Здесь вы найдете исчерпывающие и подробные решения по главам в формате PDF для класса 11 по химии.
Практика CBSE Class 11 Chemistry Questions Here
РешенияNCERT для класса 11 по научной химии CBSE PDF
Химия для 11 класса делится на 3 части: органическая (2 главы), неорганическая (5 глав) и физическая (7 глав). В таблице ниже вы найдете подробные решения NCERT для каждой главы. Учителя и ученики могут получить доступ к решениям NCERT по химии 11 класса, щелкнув прямые ссылки на этой странице.
РешенияCBSE NCERT для химии 11 класса могут быть доступны для просмотра или загрузки бесплатно без каких-либо затрат. Студентам даже не нужно регистрироваться, чтобы просмотреть / загрузить PDF-файл с решениями NCERT по химии 11 класса. Мы предоставили вам решения NCERT класса 11 по химии по главам, а также описания глав, бесплатные учебные материалы и пробные тесты.
CBSE Chemistry Класс 11 NCERT Solutions PDF:
Щелкните ссылку, чтобы получить доступ к решению NCERT для главы.Эти решения были подготовлены лучшими преподавателями Embibe в простой, лаконичной и понятной форме.
Преимущества обращения к решениям CBSE NCERT для химии класса 11 от Embibe
NCERT Class 11 Chemistry на первый взгляд может показаться устрашающим. Он состоит из множества формул, химических уравнений и определений. Есть теории и явления, которые вы можете понять, но вам также нужно помнить такие вещи, как атомный номер, массовое число, выучить периодическую таблицу и многое другое.
РешенияCBSE NCERT для химии класса 11 имеют свои преимущества и преимущества. Чем больше вы будете практиковаться в ответах на приведенные здесь вопросы, тем лучше будете подготовлены к предстоящим экзаменам. Поскольку предлагаемые здесь решения относятся к упражнениям в конце главы, они наверняка также помогут вам при сдаче конкурсных экзаменов, и мы расскажем вам о некоторых преимуществах и преимуществах решения CBSE NCERT Solutions for Class 11 Chemistry:
- Студенты поймут новое определение химии на примерах задач, представленных в решениях CBSE NCERT для химии 11 класса.
- Решения NCERT по химии 11 класса играют важную роль в предоставлении вам советов и рекомендаций по решению различных вопросов.
- Рабочие листы и вопросы, представленные в формате pdf, хорошо синхронизируются с уровнем понимания любого ученика.
- Учебник химии «Решения для класса 11» Химия включает числовые задачи, а также важные вопросы, которые помогут вам отработать каждый уровень вопросов, которые могут быть заданы на экзамене.
- Ответы CBSE NCERT Class 11 Chemistry подготовлены ведущими академическими экспертами Embibe.
- Ученики часто зацикливаются на многих вопросах, и в классе из 50-60 учеников учителя не могут сосредоточиться на каждом ребенке. Но для каждой проблемы есть решение, все, что вам нужно сделать, это найти его. Мы, в Embibe, обеспечиваем решение этой проблемы в виде решений NCERT для всех глав химии класса 11.
Решения CBSE NCERT для 11-го отдела химии: описания глав
В следующих разделах вы найдете краткое описание отдельных глав.Перед тем, как начать подготовку к CBSE к классу 11, вы должны ознакомиться с описанием глав по химии класса 11. Вы также найдете прямую ссылку на скачивание PDF-файла решения в конце описания. Эти решения NCERT бесплатны и доступны в формате PDF, так что студенты могут загрузить их и получить к ним доступ в любое время.
РешениеNCERT для химии класса 11 Глава 1: Некоторые основные понятия химии
В этом NCERT Class 11 Chemistry Chapter 1 будут освещены некоторые основные концепции химии изучающие химию на том факте, что изучение химии имеет важное значение, так как ее область охватывает все сферы жизни.Химики изучают свойства и структуру веществ и изменения, которым они подвергаются.
Все вещества содержат материю, которая может существовать в трех состояниях: твердом, жидком или газообразном. Составляющие частицы по-разному удерживаются в этих состояниях материи и проявляют свои характерные свойства.
| Глава 1: Некоторые основные концепции химии Решение — Скачать PDF |
Решение NCERT для химии класса 11 Глава 2: Структура атома
Эта глава, посвященная решению NCERT для класса 11 по химии. Глава 2 «Структура атома» научит учащихся тому, что атомы являются строительными блоками элементов.Это самые маленькие части элемента, которые вступают в химическую реакцию.
Учащиеся также узнают, что согласно квантово-механической модели атома, распределение электронов в атоме, содержащем количество электронов, делится на оболочки. Считается, что оболочки, в свою очередь, состоят из одной или нескольких подоболочек, а подоболочки состоят из одной или нескольких орбиталей, которые занимают электроны.
РешениеNCERT для химии класса 11 Глава 3: Классификация элементов и периодичность в свойствах
В этом разделе студенты изучают развитие Периодического закона и Периодической таблицы.Периодическая таблица Менделеева была основана на атомных массах. В современной периодической таблице элементы располагаются в порядке их атомных номеров в семи горизонтальных рядах (периодах) и восемнадцати вертикальных столбцах (группы или семейства). Атомные номера в периоде идут последовательно, тогда как в группе они увеличиваются по шаблону.
| Глава 3: Классификация элементов и периодичность в свойствах Решение — Скачать PDF |
Решение NCERT для химии класса 11 Глава 4: Химическая связь и молекулярная структура
Это решение NCERT для класса 11 по химии, глава 4, «Химическая связь и молекулярная структура» учит студентов тому, что ионное соединение изображается как трехмерное скопление положительных и отрицательных ионов в упорядоченной структуре, называемой кристаллической решеткой.В кристаллическом твердом теле существует баланс заряда между положительными и отрицательными ионами. Кристаллическая решетка стабилизируется энтальпией образования решетки.
| Глава 4: Химическая связь и молекулярная структура Раствор — Скачать PDF |
Решение NCERT для химии класса 11 Глава 5: Состояния вещества
Межмолекулярные силы действуют между частицами материи.Эти силы отличаются от чисто электростатических сил, которые существуют между двумя противоположно заряженными ионами. Кроме того, они не включают силы, которые удерживают атомы ковалентной молекулы вместе посредством ковалентной связи. Конкуренция между тепловой энергией и межмолекулярными взаимодействиями определяет состояние вещества.
Решение NCERT для химии класса 11 Глава 6: Термодинамика
Эта глава по химии NCERT класса 11 Глава 6 Термодинамика учит учащихся, что термодинамика имеет дело с изменениями энергии в химических или физических процессах и позволяет нам изучать эти изменения количественно и делать полезные прогнозы.Химические или физические процессы приводят к выделению или поглощению тепла (q), часть которого может быть преобразована в работу (w).
Решение NCERT для химии класса 11 Глава 7: Равновесие
Когда количество молекул, покидающих жидкость и превращающихся в пар, равно количеству молекул, возвращающихся в жидкость из пара, считается, что равновесие достигнуто и носит динамический характер. Равновесие может быть установлено как для физических, так и для химических процессов, и на этой стадии скорости прямой и обратной реакций равны.Далее студенты узнают, что все вещества, проводящие электричество в водных растворах, называются электролитами.
Решение NCERT для химии класса 11 Глава 8: Редокс-реакции
Этот урок NCERT Class 11 Chemistry Chapter 8 Redox Reactions научит учащихся тому, что окислительно-восстановительные реакции образуют важный класс реакций, в которых окисление и восстановление происходят одновременно. Трехуровневая концептуализация, а именно классическая электроника и степень окисления, которые обычно присутствуют в текстах, подробно представлена в этой главе.
Решение NCERT для химии класса 11 Глава 9: Водород
Из этой главы студенты узнают, что водород — самый легкий атом, имеющий только один электрон. Потеря этого электрона приводит к образованию элементарной частицы — протона. Таким образом, он уникален по своему характеру. Он имеет три изотопа, а именно: протий, дейтерий и тритий. Среди этих трех только тритий радиоактивен. Несмотря на сходство как с щелочными металлами, так и с галогенами, он занимает отдельное место в периодической таблице из-за своих уникальных свойств.
РешениеNCERT для химии класса 11 Глава 10: Элементы s-блока
Из этой главы учащиеся узнают, что физические и химические свойства щелочного металла имеют закономерную тенденцию к увеличению атомных номеров. Учащиеся также будут знать, что атомные и ионные размеры увеличиваются, а энтальпии ионизации систематически снижаются по группе. В некоторой степени аналогичные тенденции наблюдаются среди свойств щелочноземельных металлов.
РешениеNCERT для химии класса 11 Глава 11: Элементы p-блока
p-Блок периодической таблицы уникален с точки зрения наличия всех типов элементов — металлов, неметаллов и металлоидов.В периодической таблице Менделеева шесть групп элементов p-блока, пронумерованных от 13 до 18. Электронная конфигурация их валентной оболочки ns2np1-6 (кроме He). Различия во внутреннем ядре их электронной конфигурации сильно влияют на их физические и химические свойства. Вследствие этого наблюдается множество различий в свойствах этих элементов.
Решение NCERT для химии класса 11 Глава 12: Органическая химия — некоторые основные принципы и методы
В этом разделе студенты изучат некоторые основные понятия о структуре и реакционной способности органических соединений, которые образуются за счет ковалентной связи.Природа ковалентной связи в органических соединениях может быть описана в терминах концепции гибридизации орбиталей, согласно которой углерод может иметь sp3, sp2 и sp гибридизированные орбитали. Гибридные атомы углерода sp3, sp2 и sp находятся в таких соединениях, как метан, метан и этин соответственно.
| Глава 12: Органическая химия — некоторые основные принципы и методы Решение — Скачать PDF |
Решение NCERT для химии класса 11 Глава 13: Углеводороды
В этом документе NCERT Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons учащиеся узнают, что углеводороды представляют собой соединения только углерода и водорода.Углеводороды в основном получают из угля и нефти, которые являются основными источниками энергии. Нефтехимия — это основные исходные материалы, используемые для производства большого количества коммерчески важных продуктов. Важными реакциями алканов являются свободнорадикальное замещение, горение, окисление и ароматизация.
Решение NCERT для химии класса 11 Глава 14: Химия окружающей среды
Изучая эту тему, учащиеся узнают, что химия окружающей среды играет важную роль в окружающей среде.Химические вещества, присутствующие в окружающей среде, либо встречаются в природе, либо образуются в результате деятельности человека. Загрязнение окружающей среды — это результат нежелательных изменений в окружающей среде, которые оказывают вредное воздействие на растения, животных и людей. Загрязняющие вещества существуют во всех трех состояниях вещества.
Некоторые важные вопросы для класса 11 по химии
Ниже мы предоставили несколько важных вопросов, которые помогут вам понять главы, а также помогут вам лучше выставить оценки.
| Вопрос 1: Как материя классифицируется на макроскопическом уровне? |
| Вопрос 2: Классифицируйте следующие вещества как элементы, соединения и смеси — воду, чай, серебро, сталь, кислород и золото. |
| Вопрос 3: Запишите электронную конфигурацию (i) Ag 3+, (ii) Fe 3+ (iii) Cr 2+ и Zn 2+. Укажите количество неспаренных электронов в каждом случае. |
| Вопрос 4: Как Менделеев расположил элементы в своей периодической таблице? |
| Вопрос 5: Объясните, почему катионы меньше, а анионы больше по радиусу, чем их родительский атом? |
| Вопрос 6: Опишите основные особенности периодической таблицы Менделеева? |
| Вопрос 7: Назовите главную черту объяснения Косселя химической связи.3+ иона? |
| Вопрос 11: Было обнаружено, что 221,4 Дж требуется для нагрева 30 г этанола с 15 ° C до 18 ° C. рассчитать (а) удельную теплоемкость и (б) молярную теплоемкость этанола. |
| Вопрос 12: Найдите степень окисления серы в следующих соединениях: h3S, h3SO4. |
| Вопрос 13: Почему водород занимает уникальное положение в периодической таблице? |
| Вопрос 14: Почему жесткая вода не образует пену с мылом? |
| Вопрос 15: В чем разница между пищевой содой и разрыхлителем? |
| Вопрос 16: Атомные радиусы щелочноземельных металлов меньше, чем у соответствующих щелочных металлов.Объяснить, почему? |
| Вопрос 17: Обсудите различные типы оксидов. |
| Вопрос 18: Обсудите общие характеристики элементов Группы 15 с точки зрения их электронной конфигурации, степени окисления, размера атомов, энтальпии ионизации и электроотрицательности. |
| Вопрос 19: Карбонизация бензила более стабильна, чем карбонизация этила. Обоснуйте. |
| Вопрос 20: Как вы превратите следующие соединения в бензол? (i) Ацетилен (ii) Бензойная кислота (iii) Циклогексан (iv) Бензолдиазония хлорид. |
| Вопрос 21: Какое вредное воздействие оказывают оксиды азота в атмосфере? |
| Вопрос 22: Какие реакции участвуют в истощении озонового слоя в атмосфере? |
Как решения NCERT могут помочь вам получить более высокие оценки?
РешенияNCERT, предоставленные нами, содержат решения для интерактивных вопросов, а также вопросы упражнения в конце главы. Эти решения помогут вам в учебе, а также помогут улучшить свой результат следующим образом:
— Подготовлено экспертами : Решения NCERT, разработанные в Embibe, были тщательно отобраны экспертами, имеющими многолетний опыт работы в этой области.Эти решения подготовлены с учетом обучаемости учащихся.
— Следуйте Последним руководящим принципам CBSE: Решения, приведенные в этой статье, соответствуют последним рекомендациям CBSE, где студенты могут слепо полагаться на них и использовать объяснения и шаги решения на экзаменах.
— Ответьте на все вопросы: Здесь мы предоставили решения для всех без исключения вопросов, связанных с целым текстом и упражнениями в конце главы. После загрузки вам больше не понадобится помощь для решения вопросов из учебника химии NCERT.
— Легко понять: Ответы также сопровождались диаграммами и соответствующими пояснениями. Подробные решения помогают учащимся легко понять решения / концепции и применить их.
— Помогает в получении хороших оценок: Решения можно использовать для получения более высоких оценок, потому что вы можете следовать шагам для решения числовых задач, определений и других теорий.
— Приготовление и справочный материал: Эти химические растворы CBSE NCERT являются одними из лучших учебных материалов.Студенты могут использовать их в качестве справочного руководства при изучении или редактировании глав.
Как подготовиться к 11 классу химии?
Ниже приведены некоторые советы по подготовке к уроку химии 11:
- Внимательно прочтите главы и разберитесь в каждой концепции, реакции, процессе и механизме.
- Делайте заметки или диаграммы, чтобы запомнить реакции, уравнения и формулы.
- Пишите все, что читаете. Это поможет вам запомнить концепции надолго.
- Решите все вопросы с упражнениями из учебника NCERT.
- Решите образцы заданий и заданий за предыдущие годы, чтобы получить представление о типах вопросов, задаваемых на экзамене.
- Пройдите пробные тесты по времени, чтобы повысить скорость и точность.
Часто задаваемые вопросы о решениях NCERT для химии класса 11
Ниже приведены некоторые из часто задаваемых вопросов, которые обычно задают студенты:
Q1: Где я могу получить решения NCERT для химии 11 класса pdf?A1: Учащиеся могут бесплатно скачать главу по химии 11 класса в формате pdf на Embibe.
Q2: Сколько глав по химии в классе 11?A2: Всего 14 глав в книге по химии 11 класса
Q3: Как я могу скачать NCERT Chemistry Class 11 part 1 pdf?A3: Чтобы загрузить pdf-файл урока химии 11, откройте эту статью и щелкните ссылки на главы.
Q4: Какие 3 части химии? A4: Химия класса 11 делится на 3 части:
1) Физическая
2) Органическая
3) Неорганическая
A5: Это полностью зависит от вас.Если вы будете действовать разумно, грамотно использовать ресурсы, пройти пробные тесты, то процесс обучения вам понравится. Однако, учитывая курс, этот предмет более длинный по сравнению с другими предметами.
Q6: Как решения NCERT для химии 11 класса могут помочь вам хорошо сдать экзамен?A5: Эти решения действуют как справочное руководство, на которое вы можете положиться. Это поможет вам быстро пересмотреть программу. Поскольку они доступны как в онлайн, так и в автономном режиме, вы можете использовать их, когда захотите.Доступные шаги помогут вам с легкостью понять числовые значения.
Максимально используйте учебные материалы, доступные на Embibe
Теперь, когда вам нужно готовиться к экзамену 11 класса, вы можете улучшить свою подготовку, решая практические вопросы. Эти практические вопросы доступны бесплатно на Embibe. У вас есть время, чтобы решить Практические вопросы PCMB для класса 12. Эти вопросы сформулированы таким образом, чтобы подготовить вас к любому уровню сложности, который может встретиться на вашем пути сейчас или в будущем.Наряду с решением практических вопросов вы также можете пройти пробный тест PCMB Class 12 Mock Test , чтобы добавить дополнительных преимуществ к вашей подготовке. Если вы планируете в ближайшем будущем появиться для NEET или JEE Mains, то попытка пробных тестов для медицины и инженерии на Embibe — это выход, чтобы получить невероятно хорошие результаты.
Ознакомьтесь с решениями CBSE Class 11 для других тем здесь:
Пройдите пробный химический тест CBSE Class 11 сейчас
Если у вас есть какие-либо вопросы по этой статье о решениях CBSE NCERT для химии класса 11 , сообщите нам об этом в разделе комментариев ниже, и мы скоро свяжемся с вами.


 М. Радецкий Т. Н. Курьянова 2000
М. Радецкий Т. Н. Курьянова 2000 Р., 2011, к учебнику по химии за 8 класс, Габриелян О.С.
Р., 2011, к учебнику по химии за 8 класс, Габриелян О.С. Г.
Г. 9 класс: учебник для общеобразовательных учреждений, Габриелян О.С., 2004, 2011»
9 класс: учебник для общеобразовательных учреждений, Габриелян О.С., 2004, 2011» Е., Фельдман Ф.Г., 1999
Е., Фельдман Ф.Г., 1999 Химия. 10 класс, Габриелян О.С., 2007»
Химия. 10 класс, Габриелян О.С., 2007» Е., Фельдман Ф.Г.
Е., Фельдман Ф.Г. Г., 2010
Г., 2010 Г., 2002»
Г., 2002» С., Лысова Г.Г.
С., Лысова Г.Г. Теория строения органических соединений А. М. Бутлерова
Теория строения органических соединений А. М. Бутлерова youtube.com/watch?v=bXg1VcU9hBk
youtube.com/watch?v=bXg1VcU9hBk Состав, строение, гомологический ряд, изомерия, номенклатура
Состав, строение, гомологический ряд, изомерия, номенклатура edu.ru/subject/lesson/6148/main/170465/
edu.ru/subject/lesson/6148/main/170465/ edu.ru/subject/lesson/5727/main/150581/
edu.ru/subject/lesson/5727/main/150581/ Классификация, состав. Значение углеводов для жизни человека. Глюкоза
Классификация, состав. Значение углеводов для жизни человека. Глюкоза edu.ru/subject/lesson/4743/main/150746/
edu.ru/subject/lesson/4743/main/150746/ edu.ru/subject/lesson/6296/main/212593/
edu.ru/subject/lesson/6296/main/212593/ edu.ru/subject/lesson/6332/main/151024/
edu.ru/subject/lesson/6332/main/151024/ edu.ru/subject/lesson/5581/main/151084/
edu.ru/subject/lesson/5581/main/151084/ Реакции в растворах электролитов
Реакции в растворах электролитов Промышленное получение металлов. Производство чугуна и стали
Промышленное получение металлов. Производство чугуна и стали edu.ru/subject/lesson/4961/main/151297/
edu.ru/subject/lesson/4961/main/151297/ edu.ru/subject/lesson/3523/main/151163/
edu.ru/subject/lesson/3523/main/151163/ Средства борьбы с бытовыми насекомыми. Средства личной гигиены и косметики
Средства борьбы с бытовыми насекомыми. Средства личной гигиены и косметики 1:
1:  2:
2: 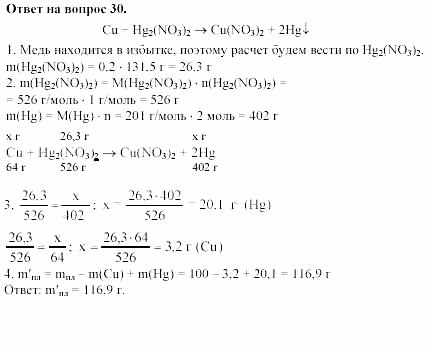 7:
7:  8:
8: