ГДЗ по химии 11 класс Гузей Суровцева Лысова решебник
Практические занятия и лабораторные опыты1 2 3 4 5 6 7 8 9 10 12
Лабораторные опыты1 2 3 4 5 6 7 8 9 11 12 13
Глава 32. Введение в органическую химию
§ 32.2. Особенности органической химии:1 3 6 12 14 15 16 17 18 19 20
§ 32.3. Классификация органических соединений:1 2 3 4 7
§ 32.4. Химическая связь в органических соединениях:3 4 6 7 14 15
§ 32.5. Химическая связь в органических соединениях. Геометрия молекулы:1 2 3 6 7
§ 32.6. Теория строения органических соединений:1 2 4 5
Глава 33. Предельные углеводороды
§ 33.1. Строение алканов:1 2 3 6 7 8 9 12 13 14 15 16
§ 33.2. Физические свойства алканов:2 3 6
§ 33.
§ 33.4. Циклоалканы:4 5 6
§ 33.5. Получение алканов и циклоалканов:2 3
Глава 34. Непредельные углеводороды — алкены, алкадиены, алкины, арены
§ 34.1. Строение алкенов:1 6 7 8 9 10 11
§ 34.2. Свойства алкенов:1 5 9 10 11
§ 34.3. Получение алкенов:1 2 3 4 5 6 7 8
§ 34.4. Алкадиены:1 2 3 4 5
§ 34.5. Алкины:1 2 3 4 5 6 7 8 9 11
§ 34.6. Арены:2 4 5 6 7
Глава 35. Газ, нефть, уголь
§ 35.1. Углеводороды в природе. Применение:1 2
Глава 36. Производственные углеводородов ( галагено- и азотсодержащие)
§ 36.1. Введение:1 2
§ 36.2. Галогенопроизводные углеводородов:1 2 3 5 7 8 9 10 11 12 13 14 15 16 17
§ 36.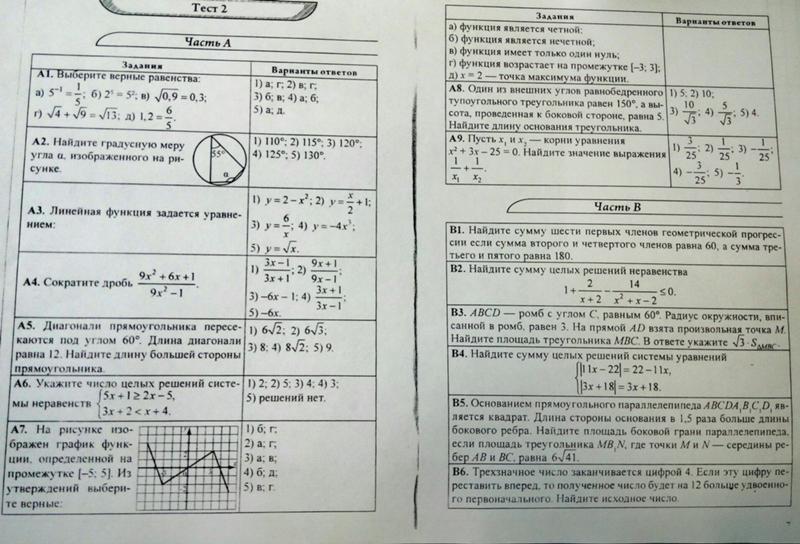 3. Нитросоединения:1
2
3
5
3. Нитросоединения:1
2
3
5
§ 36.4. Амины:1 2 3 4 6
Глава 37. Спирты, фенолы, простые эфиры, оксиды
§ 37.1. Строение и классификация спиртов:1 2 3 5 6
§ 37.2. Физические свойства спиртов и фенолов:1 2 3 5 7
§ 37.3. Химические свойства спиртов и фенолов:1 4 8 9 10 11 12 13
§ 37.4. Получение и применение спиртов:2 3 5 6
§ 37.5. Простые эфиры и оксиды:2 3
Глава 38. Альдегиды и кетоны
§ 38.1. Карбонильные соединения:1 2 3 6 7 8
Глава 39. Карбоновые кислоты и сложные эфиры
§ 39.1. Состав, классификация, строение, физические свойства карбоновых кислот:1 2 3 4 5 6 7 8 9
§ 39.2. Химические свойства карбоновых кислот:1 2 3 4 5 8
§ 39.3. Получение и применение карбоновых кислот:1 2 3 4 7 8
§ 39. 4. Мыла:1
4. Мыла:1
§ 39.5. Сложные эфиры:2 4 5 6 7 8 9 10 12 13 14 15 16 17 18
§ 39.6. Жиры:1 2 3 4 5 6 8
Глава 40. Полифункциональные соединения
§ 40.1. Галогенозамещенные кислоты:1 2 3 6
§ 40.2. Оксикислоты:1 2 3 5 6 7 8
§ 40.3. Аминокислоты:1 2 3 4 7 9 11
§ 40.4. Белки:1 2 3 4 5 6
Глава 41. Гетероциклические соединения
§ 41.1. Углеводы:1 3 4 5 6 7 8 12 13
§ 41.2. Полисахариды:1 2 3 5 9 10 11
§ 41.3. Азотистые основания:1 2 3 5
Глава 42. Высокомолекулярные вещества
§ 42.1. ВМС:1 2 3 4 5 6
§ 42.2. Строение ВМС:1 2 4 5 7 9
§42.3. Физические свойства ВМС:3
Решебник (ГДЗ) по химии 11 класс Габриелян
Глава 1. Строение вещества 1. Основные сведения о строении атома
Строение вещества 1. Основные сведения о строении атома
1 2 3 4 5 6 7 8 9
Глава 1. Строение вещества 2. Периодический закон и стоение атома
2 3 4 5 6 7 8
Глава 1. Строение вещества 3. Ионная химическая связь
1 2 3 4 5 6 7 8 9
Глава 1. Строение вещества 4. Ковалентная химическая связь
1 2 3 4 5 7 8 9 10 11 12 13
Глава 1. Строение вещества 5. Металлическая связь
1 2 3 4 6 7 8 9 10
Глава 1. Строение вещества 6. Водородная химическая связь
Строение вещества 6. Водородная химическая связь
1 2 3 4 5 6 7 8 9
Глава 1. Строение вещества 7. Полимеры
1 3 7
Глава 1. Строение вещества 8. Газообразные вещества
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Глава 1. Строение вещества 9. Жидкие вещества
1 2 3 4 5 6 7 8 9 10 11
Глава 1. Строение вещества 10. Твердые вещества
1 2 3 4 5 6 7 8 9
Глава 1. Строение вещества 11. Дисперсные системы
1 2 3 4 5 6 7 8 9 10 11
Глава 1. Строение вещества 12. Состав вещества. Смеси
Строение вещества 12. Состав вещества. Смеси
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Глава 2. Химические реакции 13. Понятие о химической реакции. Реакции, идущие без изменения состава веществ
1 2 3 4 5 6 7 8 9
Глава 2. Химические реакции 14. Классификация химических реакций, протекающих с изменением состава вещества
1 2 3 4 5 6 7 8 9
Глава 2. Химические реакции 15. Скорость химической реакции
1 2 3 5 6 7 8 9 10 11 12
Глава 2. Химические реакции 16.
1 2 3 4 5 6 7 8
Глава 2. Химические реакции 18. Гидролиз
1 2 3 4 5 6 7 8 9 10 11
Глава 2. Химические реакции 19. Окислительно-восстановительные реакции. Электролиз
1 2 3 4 5 6 7 8 9
Глава 3. Вещества и их свойства 20. Металлы
1 2 3 4 5 6 7 8
Глава 3. Вещества и их свойства 21. Неметаллы
1 2 3 4 5 6 7 8
Глава 3. Вещества и их свойства 22. Кислоты
Вещества и их свойства 22. Кислоты
1 2 3 4 5 6 7 8
Глава 3. Вещества и их свойства 23. Основания
1 2 3 4 5 6 7 8 9
Глава 3. Вещества и их свойства 24. Соли
1 2 3 5 6 8
Глава 3. Вещества и их свойства 25. Генетическая связь между классами неорганических и органических веществ
1 2 3 4 5 6 7
5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174
Решения NCERT для химии 11 класса (обновлено для 2020 г.
 ) химия помогает учащимся подробно охватить все темы Учащиеся имеют свободу и могут выбрать любую тему по своему усмотрению из Class 11 Chemistry . Они могут скачать Class 11 Chemistry NCERT Solutions , которую они хотят изучать, не выходя из дома.
) химия помогает учащимся подробно охватить все темы Учащиеся имеют свободу и могут выбрать любую тему по своему усмотрению из Class 11 Chemistry . Они могут скачать Class 11 Chemistry NCERT Solutions , которую они хотят изучать, не выходя из дома.NCERT Solutions for Class 11 Chemistry Solutions PDF
NCERT Exemplar Class 11 Chemistry Solutions
- Глава 1 Некоторые основные понятия химии
- Глава 2 Структура атома
- Глава 3 Классификация элементов и периодичность свойств
- Глава 4 Химическая связь и молекулярная структура
- Глава 5 Состояние вещества
- Глава 6 Термодинамика
- Глава 7 Равновесие
- Глава 8 Окислительно-восстановительные реакции
- Глава 9 Водород
- Глава 10 Элементы s-блока
- Глава 11 Элементы p-блока
- Глава 12 Органическая химия: некоторые основные принципы и методы
- Глава 13 Углеводороды
- Глава 14 Химия окружающей среды
Руководство по химической лаборатории CBSE Class 11
- Введение
- Основные лабораторные методы
- Viva Вопросы с ответами
- Определение точки плавления
- Viva Вопросы с ответами по определению температуры плавления
- Определение температуры кипения
- Viva Вопросы с ответами по определению температуры кипения
- Очистка химических веществ кристаллизацией
- Для приготовления кристаллов чистого сульфата меди () из данного нечистого образца медного купороса
- Для получения кристаллов калийных квасцов () из сырого образца
- Для очистки нечистого образца бензойной кислоты процессом кристаллизации
- Viva Вопросы с ответами по очистке химических веществ кристаллизацией
- экспериментов, основанных на изменении pH
- Определите значения pH соляной кислоты при различной концентрации, используя; (i) рН-бумага и (ii) универсальный индикаторный раствор
- Для определения pH различных образцов раствора NaOH с использованием: (i) индикаторной бумаги и (ii) универсального индикаторного раствора
- Определение рН растворов некоторых солей с помощью индикаторной бумаги или универсального индикатора
- Определение pH овощных и фруктовых соков с помощью индикаторной бумаги и универсального индикатора
- Сравните рН растворов соляной и уксусной кислот одинаковой концентрации
- Изучение изменения рН при титровании с помощью универсального индикатора
- (a) Изучить изменение pH раствора уксусной кислоты (слабая кислота) при добавлении ацетата натрия (b) Изучить изменение pH раствора гидроксида аммония (слабое основание) при добавлении хлорида аммония
- Вопросы Viva с ответами на эксперименты, основанные на изменении pH
- Влияние изменения концентрации на химическое равновесие
- Для изучения смещения равновесия между ионами трехвалентного железа и тиоцианат-ионами при увеличении концентрации любого из них
- Вопросы Viva с ответами о влиянии изменения концентрации на химическое равновесие
- Количественная оценка (объемный анализ)
- Приготовление раствора карбоната натрия
- Приготовление раствора щавелевой кислоты
- Приготовить 250 мл 5N из данного 12N
- Приготовить 250 мл 2М из заданных 18М
- Определите крепость данного раствора гидроксида натрия.
 Вам предоставляется раствор щавелевой кислоты
Вам предоставляется раствор щавелевой кислоты - Определите силу и молярность данного раствора соляной кислоты. Дан 0,05 М раствор .
- Данный раствор содержит 6,3 г гидратированной щавелевой кислоты,
кристалла на литр. Определить значение n(количество молекул кристаллизационной воды). Предоставлено 0,1 млн - Определить волюметрически значение n, т. е. количество молекул кристаллизационной воды в стиральной соде, 7,0 г которой растворено в 1 литре данного раствора. Предоставлено
- Вам предоставляется раствор гидрокарбоната одновалентного щелочного металла (М) с концентрацией 10,0 г на литр. Узнайте атомную массу металла (М).
- Вопросы Viva с ответами на количественную оценку (объемный анализ)
- Качественный анализ
- Для анализа данной соли на кислотные и основные радикалы
- Вопросы Viva с ответами по качественному анализу
- Обнаружение элементов в органических соединениях
- Вопросы Viva с ответами на обнаружение элементов в органических соединениях
Перейти к началу страницы.
Решения NCERT по химии для 11 класса
Решения NCERT по химии для 11 класса содержат все ответы на вопросы, заданные в учебнике. Доступные решения являются глубокими и максимально простыми. Таким образом, это химия класс 11 Решения NCERT гарантируют, что учащиеся получат максимальное понимание темы. Это поможет студентам вне экзаменационных оценок. Это поможет им развить базовое понимание предмета. Потому что этот предмет требует понимания, а не просто запоминания решений химии 11 класса. Ниже мы представляем вам обзор всех глав по химии для 11 класса, которые есть в учебнике NCERT.
Глава 1 Некоторые основные понятия химии
Этот класс 11 Химия NCERT глава 1 объясняет роль, которую играет химия в повседневной жизни. Кроме того, в этой главе объясняются законы химических соединений и природа вещества. В этом уроке химии 11 главы 1 учащиеся подробно расскажут об атомной теории Дальтона, где объясняются концепции молекул и атомов. Кроме того, в главе 1 химии 11 класса рассматриваются молекулярные массы и концепции атомных масс.
Перейти к началу страницы.
Глава 2 Структура атомов
Эта глава 2 11-го класса химии будет фундаментальной для атомов, и таким образом учащиеся узнают об открытии протона, электрона и нейтрона. Они также изучат, что такое изотопы, изобары, атомные номера и т. д. В этой главе также описываются детали модели Томсона и ее ограничения. Кроме того, в нем говорится о модели Бора и модели Резерфорда и их ограничениях. Есть некоторые подробности, касающиеся двойственной природы света и материи, принципа неопределенности Гейзенберга, принципа де Бройля, формы s-, d- и p-орбиталей, квантовых чисел и т. д. Есть также такие темы, как правило Хунда и принцип запрета Паули. которые также обсуждаются в этой главе.
Глава 3 Периодичность в свойствах и классификация элементов
В этой главе вы узнаете краткую историю периодической таблицы и ее развития, значение классификации периодической таблицы, как сформировалась нынешняя форма периодической таблицы, и т. д. Кроме того, в этой главе больше обсуждается информация о тенденциях в периодической таблице для атомов, таких как ионные радиусы, радиусы, радиусы инертного газа, электроотрицательность, электронное усиление, валентность и т. д. Всего в CBSE Class 11 Chemistry NCERT Solutions содержится 40 вопросов, которые студенты могут практиковать.
д. Кроме того, в этой главе больше обсуждается информация о тенденциях в периодической таблице для атомов, таких как ионные радиусы, радиусы, радиусы инертного газа, электроотрицательность, электронное усиление, валентность и т. д. Всего в CBSE Class 11 Chemistry NCERT Solutions содержится 40 вопросов, которые студенты могут практиковать.
Перейти к началу страницы.
Глава 4 Химическая связь и молекулярная структура
Эта глава 4 курса химии NCERT 11 поможет вам понять, что такое ковалентная связь и ионная связь. Есть более подробная информация о параметрах связей, ковалентной связи и ее полярном характере, теории связи валентности, ковалентной связи и ее геометрии, резонансе и т. д. Кроме того, в этой главе обсуждается теория VSEPR, концепции гибридизации, которые включают в себя , d и p-орбитали, различные формы некоторых молекул и многое другое. Всего в этой главе 40 вопросов, которые могут помочь учащимся попрактиковаться.
Глава 5 Состояние вещества – жидкость и газ
В этой главе учащиеся узнают о трех состояниях вещества, а также о типах связи и межмолекулярных взаимодействиях. Есть также некоторые сведения о температуре кипения и плавления, приведенные в главе. Кроме того, обсуждается роль газовых законов и то, как закон Гей-Люссака, закон Бойля, закон Авогадро и т. д. помогают учащимся понять свое идеальное поведение. Наряду с этим иллюстрируются число Авогадро, эмпирическое отклонение в газовом уравнении и идеальное уравнение, необходимое для численного.
Есть также некоторые сведения о температуре кипения и плавления, приведенные в главе. Кроме того, обсуждается роль газовых законов и то, как закон Гей-Люссака, закон Бойля, закон Авогадро и т. д. помогают учащимся понять свое идеальное поведение. Наряду с этим иллюстрируются число Авогадро, эмпирическое отклонение в газовом уравнении и идеальное уравнение, необходимое для численного.
Глава 6 Химическая термодинамика
Этот курс 11 по химии, глава 6 помогает разобраться в концепциях различных систем и их различных типов. Предусматривается также обсуждение окружающего в виде тепла, работы, энергии, интенсивных и экстенсивных свойств, функций состояния. В этой главе обсуждается первый закон термодинамики. Он включает энтальпию и внутреннюю энергию, удельную теплоемкость, теплоемкость, измерение теплоты и т. д.
Глава 7 Равновесие
Эта химия NCERT Solutions class 11 глава 7 рассказывает о концепциях равновесия в химических и физических процессах и деталях, связанных с динамической природой равновесия. Есть также некоторые идеи, связанные с законом действующих масс, факторами, влияющими на равновесие, и константой равновесия в соответствии с принципом Ле Шателье. Кроме того, также обсуждаются сведения о силе кислоты, ионизации многоосновных кислот, уравнении Гендерсона, концепции pH и т. д.
Есть также некоторые идеи, связанные с законом действующих масс, факторами, влияющими на равновесие, и константой равновесия в соответствии с принципом Ле Шателье. Кроме того, также обсуждаются сведения о силе кислоты, ионизации многоосновных кислот, уравнении Гендерсона, концепции pH и т. д.
Глава 8 Окислительно-восстановительная реакция
В этой главе учащиеся получат глубокие знания о восстановлении и окислении, а также различные сведения об окислительно-восстановительных реакциях. Кроме того, будет предоставлена информация о балансировке окислительно-восстановительных реакций, степени окисления и т. д. Всего в главе 30 вопросов, в которых также обсуждаются потери и приобретения электронов.
Глава 9 Водород
В этой главе вы узнаете о появлении водорода и его положении в периодической таблице. Наряду с этим, в этой главе также будет обсуждаться информация об изотопах, их свойствах и способах их получения. В этой главе также обсуждается информация, относящаяся к межузельным и водородно-ионным ковалентным связям.
Глава 10 Элементы S-блока
В этой главе обсуждаются элементы, присутствующие в группах 1 и 2. В ней обсуждается электронная конфигурация и их расположение. Каждый первый элемент в группе демонстрирует некоторое аномальное поведение, которое также обсуждается в этой главе. Также обсуждаются диагональные отношения, такие как атомные радиусы, изменение свойств с точки зрения энтальпии ионизации, ионных радиусов и т. Д. В этой главе также обсуждается, как получают некоторые важные соединения, такие как хлорид натрия, карбонат натрия, гидрокарбонат натрия и гидроксид натрия.
Глава 11 Некоторые элементы P-блока
В этой главе учащиеся получают более общий обзор элементов p-блока. Также имеется подробная и подробная информация об элементах группы 13, обсуждаемых в этой главе. Также обсуждается изменение степеней окисления и их свойств. В этой главе обсуждаются химические и физические свойства бора, а также его важных соединений, таких как борная кислота, бура, гидриды бора и т. д.
д.
Глава 12 Органическая химия – некоторые основные методы и принципы
В этой главе более подробно рассказывается о различных методах очистки, а также об используемых для этого количественных и качественных анализах. Кроме того, в этой главе также обсуждается информация, относящаяся к номенклатуре ИЮПАК и классификации различных органических соединений. Наряду с этим подробно рассматриваются и электронные смещения, происходящие в ковалентной связи в виде электромерного эффекта, индуктивного эффекта, гиперсопряжения, резонанса.
Глава 13 Углеводороды
В этой главе 13 химии 11 класса NCERT учащиеся подробно узнают о классификации углеводородов, их использовании, свойствах и связанных с ними реакциях. Кроме того, в этой главе говорится об алканах, алкинах и алкенах. В нем также рассказывается о соответствующей номенклатуре, физических свойствах, названиях IUPAC, химических реакциях, горении, изомерии и т. д. почва и вода. Кроме того, обсуждаются все химические реакции, происходящие в атмосфере из-за смога, основных атмосферных загрязнителей и т. д. В этой последней главе решений NCERT для химии класса 11 обсуждается озон, кислотные дожди и их реакции. В общей сложности 20 вопросов помогут учащимся понять различные альтернативные инструменты, необходимые для уменьшения загрязнения.
д. В этой последней главе решений NCERT для химии класса 11 обсуждается озон, кислотные дожди и их реакции. В общей сложности 20 вопросов помогут учащимся понять различные альтернативные инструменты, необходимые для уменьшения загрязнения.
Решения NCERT для химии в 11 классе — правильный рецепт для учащихся, которые хотят не только получать оценки на экзаменах. Мы будем держать вас в курсе всех материалов, связанных с экзаменами, на этом веб-сайте.
Дополнительные ресурсы для CBSE Class 11
NCERT Solutions
CBSE Chemistry Practical Class 11 Lab Manual
NCERT Solutions for Class 11 Chemistry Chapter 1
NC ERT Solutions for Class 11 Chemistry Chapter 1 Некоторые основные концепции химии являются частью Химия класса 11 NCERT Solutions. Здесь мы дали решения NCERT для химии класса 11. Глава 1. Некоторые основные понятия химии.
Темы и подтемы в Решения NCERT для класса 11 по химии Глава 1 Некоторые основные понятия химии :
| Название раздела | Название темы |
| 1 | Некоторые основные понятия химии |
| 1,1 | Важность химии |
| 1,2 | Природа материи |
| 1,3 | Свойства материи и их измерение |
| 1,4 | Неопределенность измерения |
| 1,5 | Законы химических соединений |
| 1,6 | Атомная теория Дальтона |
| 1,7 | Атомные и молекулярные массы |
| 1,8 | Понятие кротов и молярные массы |
| 1,9 | Процентный состав |
| 1,10 | Стехиометрия и стехиометрические расчеты |
NCERT Solutions Class 11 ChemistryChemistry Lab ManualChemistry Sample Papers
NCERT TEXTBOOK РЕШЕННЫЕ ВОПРОСЫ
Вопрос 1. Рассчитайте молекулярную массу следующего :
Рассчитайте молекулярную массу следующего :
(i) H 2 0 (ii) C0 2 (iii) CH 4
Ответ: (i) Молекулярная масса H 2 O = 2(1,008 а.е.м. ) + 16,00 а.е.м. = 18,016 а.е.м.
(ii) Молекулярная масса CO 2 = 12,01 а.е.м. + 2 x 16,00 а.е.м. = 44,01 а.е.м. 0009
Вопрос 2 , Рассчитайте массовые проценты различных элементов, присутствующих в сульфате натрия ( Na 2 SO 4 ).
Ответ:
Дополнительные учебные материалы CBSE Class 11
- Решения NCERT
- Решения NCERT, класс 11, математика
- Решения NCERT, класс 11, физика
- Решения NCERT, класс 11, химический состав
- Решения NCERT, класс 11, биология
- Решения NCERT, класс 11, хинди
- Решения NCERT, класс 11, английский язык
- Решения NCERT, класс 11, бизнес-исследования
- Решения NCERT, класс 11, бухгалтерский учет
- Решения NCERT Класс 11 Психология
- Решения NCERT, класс 11, предпринимательство
- Решения NCERT Класс 11 Экономическое развитие Индии
- Решения NCERT, класс 11, информатика
Вопрос 3. Определите эмпирическую формулу оксида железа, содержащего 69,9 % железа и 30,1 % кислорода по массе.
Определите эмпирическую формулу оксида железа, содержащего 69,9 % железа и 30,1 % кислорода по массе.
Ответ:
Вопрос 4. Рассчитайте количество углекислого газа, которое может образоваться при
(i) 1 моль углерода сгорает в воздухе.
(ii) 1 моль углерода сгорает в 16 г кислорода.
(iii) 2 моля углерода сгорают в 16 г кислорода.
Ответ: Сбалансированное уравнение горения углерода в кислороде/воздухе:
(i) В воздухе сгорание завершается. Следовательно, C0 2 образуется при сгорании 1 моля углерода = 44 г. (ii) Поскольку доступно только 16 г кислорода, он может соединиться только с 0,5 моля углерода, т. е. кислород является ограничивающим реагентом. Следовательно, произведено C0 2 = 22 г. (iii) Здесь снова кислород является ограничивающим реагентом. 16 г кислорода могут соединиться только с 0,5 моль углерода. C0 2 , произведенный повторно, равен 22 г.
C0 2 , произведенный повторно, равен 22 г.
Вопрос 5. Рассчитайте массу ацетата натрия ( CH 3 COONa), необходимого для приготовления 500 мл 0,375 молярного водного раствора. Молярная масса ацетата натрия 82,0245 г моль -1
Ответ: 0,375 М водный раствор означает, что 1000 мл раствора содержит ацетат натрия = 0,375 моль
Вопрос 6. Рассчитайте концентрацию азотной кислоты в молях на литр в образце плотностью 1,41 г мл -1 и массовая доля азотной кислоты в нем составляет 69%.
Ответ: Массовая доля 69% означает, что 100 г раствора азотной кислоты содержат 69 г азотной кислоты по массе.
Молярная масса азотной кислоты HNO 3 = 1 + 14 + 48 = 63 гмоль -1
Вопрос 7. Сколько меди можно получить из 100 г медного купороса ( CuSO 4 ) ? (Атомная масса Cu = 63,5 а. е.м.)
е.м.)
Ответ: 1 моль CuS0 4 содержит 1 моль (1 г атома) Cu
Молярная масса CuS0 4 = 63,5 + 32 + 4 x 16 = 159,5 г моль -1
Таким образом, Cu, которую можно получить из 159,5 г CuS0 4 = 63,5 г
Вопрос 8. Определите молекулярную формулу оксида железа, в котором массовые проценты железа и кислорода равны 69,9 и 30,1 соответственно. Учитывая, что молярная масса оксида 1590,8 г моль -1 (Атомная масса: Fe = 55,85, O = 16,00 а.е.м.) Расчет эмпирической формулы. См. вопрос 3.
Ответ: Эмпирическая формула массы Fe 2 0 3 = 2 x 55,85 + 3 x 16,00 = 159,7 г моль – 1
Следовательно, молекулярная формула совпадает с эмпирической формула, а именно Fe 2 0 3 .
Вопрос 9. Рассчитайте атомную массу (среднюю) хлора, используя следующие данные:
Рассчитайте атомную массу (среднюю) хлора, используя следующие данные:
Ответ:
Вопрос 10. В трех молях этана ( C 2 H 6 ), рассчитайте следующее:
(i) Количество молей атомов углерода (ii) Количество молей атомов водорода
(iii) Количество молекул этана
Ответ: (i) 1 моль C 2 H 6 содержит 2 моля атомов углерода
.•. 3 моля C 2 H 6 будет атомов C = 6 молей
(ii) 1 моль C 2 H 6 содержит 6 молей атомов водорода
.•. 3 моля С 2 Н 6 будут содержать атомов Н = 18 молей
Вопрос 11. Какова концентрация сахара ( С 12 Н 22 О 11 ) в молях л -1 , если его 20 г растворить в достаточном количестве воды, чтобы получить конечный объем до 2 л?
Ответ:
Вопрос 12. Если плотность метанола равна 0,793 кг л -1 , какой его объем потребуется для приготовления 2,5 л его 0,25 М раствора?
Если плотность метанола равна 0,793 кг л -1 , какой его объем потребуется для приготовления 2,5 л его 0,25 М раствора?
Ответ:
Вопрос 13. Давление определяется как сила, приходящаяся на единицу площади поверхности. Единица давления в СИ, паскаль, показана ниже: 1 Па = 1 Нм -2 . Если масса воздуха на уровне моря 1034 г см -2 , вычислить давление в паскалях.
Ответ: Давление — это сила (т. е. вес), действующая на единицу площади. Но вес = мг
Вопрос 14. Что такое единица массы в СИ?
Ответ: Единицей массы в системе СИ является килограмм (кг).
Вопрос 15. Сопоставьте следующие префиксы с их кратными:
Ответ:
Вопрос 16. Что вы понимаете под значащими цифрами?
Что вы понимаете под значащими цифрами?
Ответ: Цифры в правильно записанном измерении называются значащими цифрами. Он также определяется следующим образом. Общее количество цифр в числе, включая последнюю цифру, значение которой неизвестно, называется числом значащих цифр.
Вопрос 17. В пробе питьевой воды обнаружено сильное загрязнение хлороформом, ХНСли, предположительно канцерогенным по своей природе. Уровень загрязнения составил 15 частей на миллион (по массе).
(i) Выразите это в процентах по массе
(ii) Определите моляльность хлороформа в пробе воды.
Ответ:
Вопрос 18. Выразите в научной записи:
(i) 0,0048 (v) 6,0012 (ii) 234 000 (iii) 8008 (iv) ) 500.0
Ответ:
Вопрос 19. Сколько значащих цифр в следующем?
(i) 0,0025 (ii) 208 (iii) 5005 (iv) 126 000
(v) 500. 0 (vi) 2.0034
0 (vi) 2.0034
Ответ: (i) 2 (ii) 3 (iii) 4 (iv) 3 (v) 4 (vi) 5.
Вопрос 20. Округление до трех значащих цифр:
(i) 34,216 (ii) 10,4107 (iii) 0,04597 (iv) 2808
Ответ: (i) 34,2 (ii) 10,4 (iii) 0,0460 (iv) ) 2810
Вопрос 21. Следующие данные были получены, когда диазот и молекулярный кислород реагируют вместе с образованием соединений:
Ответ: (a) Зафиксировав массу диазота как 28 г, объединенные массы кислорода будут 32, 64, 32 и 80 г в данных четырех оксидах. Они находятся в соотношении 1 : 2 : 1 : 5, что является простым соотношением целых чисел. Следовательно, приведенные данные подчиняются закону кратных пропорций.
Вопрос 22.
Ответ:
Вопрос 23. В реакции A + B2——> AB2 укажите ограничивающий реагент, если он есть, в следующих 900 04 смеси
(i) 300 атомов А + 200 молекул В
(ii) 2 моль А + 3 моль В
(iii) 100 атомов А + 100 молекул В 9012 4 (iv) 5 моль А + 2,5 моль В
(v) 2,5 моль А + 5 моль В
Ответ: (i) Согласно данной реакции 1 атом А взаимодействует с 1 молекулой В
. •. 200 молекул В прореагируют с 200 атомами А, а 100 атомов А останутся непрореагировавшими
•. 200 молекул В прореагируют с 200 атомами А, а 100 атомов А останутся непрореагировавшими
. Следовательно, B является лимитирующим реагентом, а A является избыточным реагентом.
(ii) По данной реакции 1 моль А взаимодействует с 1 молем В
.•. 2 моля А будут реагировать с 2 молями В. Следовательно, А является лимитирующим реагентом.
(iii) Без ограничивающего реагента.
(iv) 2,5 моль B будет реагировать с 2,5 моль A. Следовательно, B является лимитирующим реагентом.
(v) 2,5 моль А будет реагировать с 2,5 моль В. Следовательно, А является лимитирующим реагентом.
Вопрос 24. Диазот и диводород реагируют друг с другом с образованием аммиака в соответствии со следующим химическим уравнением: (i) N 2 (g) + 3 H 2 (g) —> 2Nh4 (g)
(ii) Будет ли любое из два реагента остаются непрореагировавшими?
(iii) Если да, то какой и какова его масса?
Ответ:
Вопрос 25. Как 0,50 моль Na 2 C0 3 и 0,50 М Na 2 C0 3 отличается?
Как 0,50 моль Na 2 C0 3 и 0,50 М Na 2 C0 3 отличается?
Ответ: Молярная масса Na 2 C0 3 = 2 x 23 + 12 + 3 x 16 = 106 г моль -1 0,50 моль Na 2 C0 90 338 3 означает 0,50 x 105 г = 53 г. 0,50 М Na2CO3 означает 0,50 моль, т. е. в 1 л раствора содержится 53 г Na 2 C0 3 .
Вопрос 26. Если десять объемов газообразного водорода вступают в реакцию с пятью объемами газообразного водорода, сколько объемов водяного пара может образоваться?
Ответ: H 2 и 0 2 реагируют по уравнению 002 Итак, 2 тома H 2 реагирует с 1 объемом 0 2 с образованием 2 объемов водяного пара. Следовательно, 10 объемов H 2 полностью прореагируют с 5 объемами 0 2 с образованием 10 объемов водяного пара.
Вопрос 27. Переведите следующие единицы в основные единицы:
(i) 28,7 пм (ii) 15,15 мкс (iii) 25365 мг
Ответ:
Вопрос 28. В каком из следующих атомов больше всего атомов?
(i) 1 г Au (т) (ii) 1 г Na (т) (iii) 1 г Li (т) (iv) 1 г Cl 2 (г) (Атомные массы: Au = 197, Na = 23, Li = 7, Cl = 35,5 ам.
Ответ:
Вопрос 30.
Ответ:
Вопрос 31. Сколько должно быть значащих цифр в ответ на следующее?
Ответ: (i) Наименее точный термин имеет 3 значащих цифры (т. е. 0,112). Следовательно, ответ должен состоять из 3 значащих цифр.
(ii) Оставляя точное число (5), второй член имеет 4 значащих цифры. Следовательно, ответ должен состоять из 4 значащих цифр.
(iii) В данном дополнении наименьшее количество знаков после запятой в члене равно 4. Следовательно, ответ должен иметь 4 значащих.
Следовательно, ответ должен иметь 4 значащих.
Вопрос 32. Используйте данные, приведенные в следующей таблице, для расчета молярной массы встречающегося в природе аргона.
Ответ: Молярная масса Ar = 35,96755 x 0,00337 + 37,96272 x 0,00063 + 39,96924 x 0,99600 = 39,948 г моль -1
Вопрос 33. Подсчитайте количество атомов в каждом из следующих:
(i) 52 моля He (ii) 52 ед. He (iii) 52 г He
Ответ:
Вопрос 34. Топливный газ для сварки содержит только углерод и водород. Сжигание небольшого его образца в кислороде дает 3,38 г углекислого газа, 0,690 г воды и никаких других продуктов. Установлено, что объем 10,0 л (измеренный в STP) этого сварочного газа весит 11,6 г. Рассчитайте (i) эмпирическую формулу, (ii) молярную массу газа и (iii) молекулярную формулу.
Ответ:
Вопрос 35. Карбонат кальция реагирует с водным раствором HCl по реакции ———-> CaCl 2 (водн.) + C0 2 (г) + H 2 O (л).
Карбонат кальция реагирует с водным раствором HCl по реакции ———-> CaCl 2 (водн.) + C0 2 (г) + H 2 O (л).
Какая масса CaC0 3 требуется для полной реакции с 25 мл 0,75 М HCl?
Ответ: Шаг 1. Для расчета массы HCl в 25 мл 0,75 М HCl
1000 мл 0,75 М HCl содержат HCl = 0,75 моль = 0,75 x 36,5 г = 24,375 г
Шаг 2. Для расчета массы CaC0 3 реагирует полностью с 0,9125 г HCl
CaC0 3 (т) + 2HC1 (водн.)———->CaCl 2 (водн.) +C0 2 (г) + H 2 O
2 моль HCl , т. е. 2 x 36,5 г = 73 г HCl полностью реагируют с CaC0 3 = 1 моль = 100 г
Вопрос 36. Хлор получают в лаборатории обработкой диоксида марганца (Mn0 2 ) с водным раствором соляной кислоты по реакции.
4 HCl (водн.) + Mn0 2 (т) ———–> 2 H 2 O (ж) + Mn Cl 2 (водн.) + 9 0004 Класс 2 (g)
Сколько граммов HCl вступает в реакцию с 5,0 г диоксида марганца? (Атомная масса Mn = 55 ед.)
Ответ: 1 моль Mn0 2 , т. е. 55 + 32 = 87 г Mn0 2 реагируют с 4 молями HCl, т. е. 4 х 36. 5 г = 146 г HCl.
ДОПОЛНИТЕЛЬНЫЕ РЕШЕННЫЕ ВОПРОСЫ
I. Очень короткие вопросы типа ответа
Вопрос 1. Что такое молярная единица СИ?
Ответ: Единица молярности СИ = моль дм -3
Вопрос 2. Что вы понимаете под стехиометрическими коэффициентами в химическом уравнении?
Ответ: Коэффициенты реагента и продукта, входящие в химическое уравнение, представленное в сбалансированной форме, известны как стехиометрические коэффициенты.
Например, N 2 (г) + 3H 2 (г) ———> 2 NH 3 (г)
Стехиометрические коэффициенты равны 1, 3 и 2 соответственно.
Вопрос 3. Приведите пример молекулы, в которой отношение молекулярной формулы в шесть раз больше эмпирической формулы.
Ответ: Соединение представляет собой глюкозу. Его молекулярная формула C 6 H 12 O 6 , а эмпирическая формула CH 2 O.
Вопрос 4. Что такое атом согласно атомной теории Дальтона?
Ответ: Согласно атомной теории Дальтона, атом — это первичная частица материи, которая не может быть далее разделена.
Вопрос 5. Почему воздух не всегда считается однородной смесью?
Ответ: Это связано с присутствием частиц пыли.
Вопрос 6. Дайте определение термину «единица измерения».
Ответ: Определяется как эталон, выбранный для измерения физической величины.
Вопрос 7. Дайте определение закона сохранения массы.
Ответ: Утверждается, что материя не может быть ни создана, ни уничтожена.
Вопрос 8. Как эмпирическая формула соединения связана с его молекулярной формулой?
Ответ: Молекулярная формула = (эмпирическая формула)n, где n — целое положительное число.
Вопрос 9. Сколько атомов кислорода содержится в 18 г воды?
Ответ: Молярная масса воды 18 г/моль.
Количество атомов кислорода в 18 г воды = 6,02 x 10 23
Вопрос 10. Назовите два фактора, которые вносят неопределенность в измеренные значения.
Ответ: (i) Надежность измерительного прибора.
(ii) Квалификация лица, проводящего измерение.
Вопрос 11. Назовите закон Авогадро.
Ответ: В равных объемах всех газов при одинаковых температуре и давлении содержится одинаковое количество молекул.
Вопрос 12. Чем 0,5 мл NaOH отличаются от 0,5 М NaOH?
Ответ: 0,5 мл NaOH означает 0,5 моль (20,0 г) NaOH, 0,5 М NaOH означает, что 0,5 моль (20,0 г) NaOH растворено в 1 л его раствора.
Вопрос 13. Что такое одна а.е.м. или одно «у»?
Ответ: 1 а.е.м. или 1 u = 1/12-й массы атома углерода 12.
Вопрос 14. Сколько значащих цифр в числе 1,050 х 10 4 ?
Ответ: Четыре.
II. Вопросы типа краткого ответа
Вопрос 1. Дайте определение моляльности. Как моляльность зависит от температуры?
Ответ: Моляльность определяется как количество молей растворенного вещества на килограмм растворителя.
Моляльность раствора не зависит от температуры.
Вопрос 2. Переведите 2,6 минуты в секунды.
Ответ: Мы знаем, что 1 мин = 60 с
Коэффициент пересчета = 60 с/(1 мин)
2,6 мин = 2,6 мин x коэффициент преобразования = 2,6 x 60 с/1 мин = 156 с.
Вопрос 3. Выразите до четырех значащих цифр следующее.
Ответ:
Вопрос 4. Подсчитайте количество молей в каждом из следующих.
Ответ:
Вопрос 5. При анализе установлено, что соединение содержит C = 34,6%, H = 3,85% и O = 61,55%. Вычислите эмпирическую формулу.
Ответ: Шаг I. Вычисление простейших целочисленных отношений элементов.
Простейшие соотношения целых чисел различных элементов: C:H:O::3:4:4
Шаг II. Написание эмпирической формулы соединения.
Эмпирическая формула соединения = C 3 H 4 O 4 .
Вопрос 6. Вычислите:
(a) Масса 2,5 г атомов магния,
(b) Грамм атома в 1,4 г азота (Атомная масса Mg = 24, N = 14)
Ответ: (a) 1 грамм атома Mg = 24 г
2,5 грамма атома Mg = 24 x 2,5 = 60 г
(b) 1 грамм атома N = 14 г;
14 г N = 1 грамм атома 1
1,4 г N = 1/14 x 1,4 = 0,1 грамм атома.
Вопрос 7. Плотность воды при комнатной температуре 1,0 г/мл. Сколько молекул содержится в капле воды, если ее объем равен 0,05 мл?
Ответ:
Вопрос 8. Какова молекулярная масса вещества, каждая молекула которого содержит 9атомов углерода, 13 атомов водорода и 2,33 x 10 -23 г другого компонента?
Ответ:
III. Вопросы с длинным ответом
Вопрос 1. Подсчитайте количество. атомов углерода и кислорода в 11,2 л C0 2 в N.T.P.
Ответ: Этап I. Количество C0 2 молекул в 11,2 л
Вопрос 2. KCl0 3 при нагревании разлагается с образованием KCl и 0 2 . Какой объем 0 2 при НТП выделяется 0,1 моля KCl 0 3 ?
Ответ: Химическое уравнение разложения KCl0 3 is
Вопрос 3. 10 мл раствора NaCl, содержащего KCl, при выпаривании давали 0,93 г смешанной соли, что давало 1,865 г AgCl от реагирует с AgN0 3 раствор. Рассчитайте количество NaCl в 10 мл раствора.
10 мл раствора NaCl, содержащего KCl, при выпаривании давали 0,93 г смешанной соли, что давало 1,865 г AgCl от реагирует с AgN0 3 раствор. Рассчитайте количество NaCl в 10 мл раствора.
Ответ: Уравнение химической реакции:
Вопрос 4. Стоимость поваренной соли (NaCl) и поваренного сахара ( C 12 H 22 О 11 ) 1 рубль/кг и 6 руб/кг соответственно. Рассчитайте их стоимость за моль.
Ответ: (a) Стоимость поваренной соли (NaCl) за моль
Молекулярная масса NaCl в граммах = 23 + 35,5 = 58,5 г. Теперь стоимость 1000 г NaCl = 2·9 рупий.0124
(b) Стоимость столового сахара (C 12 H 22 O 11 ) за моль
Грамм молекулярной массы (C 12 H 22 O 9033 8 11 ) = 12 х 12 + 22 х 1 = 16 х 1 = 144 + 22 + 176 = 342 г
Теперь стоимость 1000 г сахара = 6 рупий
Вопрос 5. В колбе Р содержится 0,5 моля газообразного кислорода. Другая колба Q содержит 0,4 моля газообразного озона. Какая из двух колб содержит большее число атомов кислорода?
В колбе Р содержится 0,5 моля газообразного кислорода. Другая колба Q содержит 0,4 моля газообразного озона. Какая из двух колб содержит большее число атомов кислорода?
Ответ: 1 молекула кислорода (O 2 ) = 2 атома кислорода
1 молекула озона (O 3 ) = 3 атома кислорода
Вопрос 6. Рассчитайте общее количество электронов, присутствующих в 1,6 г метана.
Ответ:
Вопрос 7. Плотность паров смеси N0 2 и N 90 338 2 0 4 составляет 38,3 при 27°C. Рассчитайте количество молей N0 2 в 100 г смеси.
Ответ:
Вопрос 8. Плотность паров газообразного элемента в 5 раз больше плотности кислорода при аналогичных условиях. Если молекула трехатомная, какова будет ее атомная масса?
Ответ: Молекулярная масса кислорода = 32 ед.


 Вам предоставляется раствор щавелевой кислоты
Вам предоставляется раствор щавелевой кислоты