Практические работы по химии 8 класс | Методическая разработка по химии (8 класс) на тему:
Практическая работа № 1
Правила поведения в кабинете химии, приемы безопасной работы с оборудованием и веществами. Строение пламени
Цель:
Изучить приемы обращения с простейшим лабораторным оборудованием: лабораторным штативом, спиртовкой, пробирками, колбами и т. д. Изучить строение пламени. Изучить правила техники безопасности, которые требуется соблюдать при работе в школьном химическом кабинете.
Оборудование: спиртовка, лабораторный штатив, спички, пробирки, стаканчик с водой, баночка для отработанных реактивов, посуда химическая ( разная)
ход работы
- Правила по технике безопасности при работе в кабинете химии. ( работа с текстом учебника с. 9-10)
- Приемы обращения с лабораторным штативом. Зарисовать лабораторный штатив, подписать основные части, сделать вывод.
- Приемы обращения со спиртовкой. 9 сделать рисунок, сформулировать вывод)
- Изучение строения пламени.
 ( сделать рисунок, определить основные части пламени, сделать вывод.
( сделать рисунок, определить основные части пламени, сделать вывод. - Сделать общий вывод
Практическая работа 2
Очистка загрязненной поваренной соли.
Цель:
Научиться простейшим способам очистки веществ: фильтрованию и выпариванию. Научить выполнять практическую работу по инструкции и оформлять отчет о химическом эксперименте.
Оборудование и реактивы: пробирки, чаша для выпаривания растворов, спиртовка, спички, фильтровальная бумага, стакан с водой, загрязненная поваренная соль
Ход работы
- Инструктаж по ТБ при проведении практической работы.
- Растворение загрязненной поваренной соли.
- Очистка полученного раствора при помощи фильрования.
- Выпаривание раствора.
Учащиеся должны ответить на следующие вопросы:
1. Какими физическими свойствами (агрегатное состояние при обычных условиях, запах, цвет, растворимость в воде) обладают поваренная соль и речной песок?
2. Как разделить компоненты смеси, используя различия в их физических свойствах? Составьте план действий.
3. Какое оборудование вам потребуется для очистки поваренной соли?
Затем учащиеся приступают к выполнению практической работы (с. 52 учебника).
Отчет о работе учащиеся оформляют в тетрадях для практических занятий в виде таблицы.
Что сделали | Что наблюдали | Выводы |
|
|
|
Сформулировать общий вывод.
Практическая работа № 3
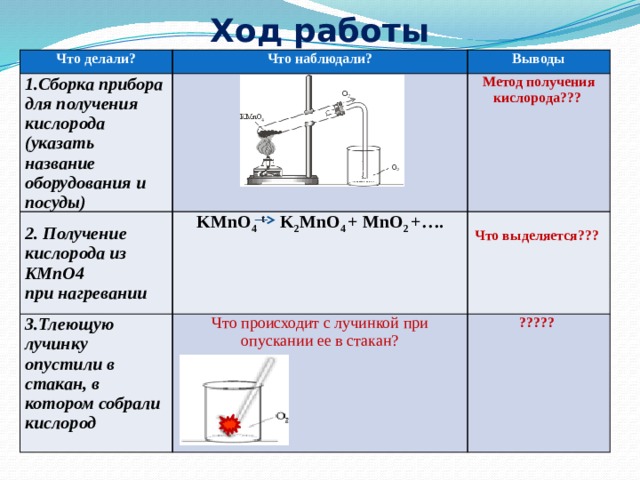
Получение и свойства кислорода
Цель: закрепить полученные знания о свойствах кислорода; продолжить формирование умений написания химических уравнений; повторить правила ТБ при проведении практических работ
Оборудование: штатив лабораторный, пробирки, газоотводные трубки, колбы, горелка, спички
Реактивы: перманганат калия, сера, уголь.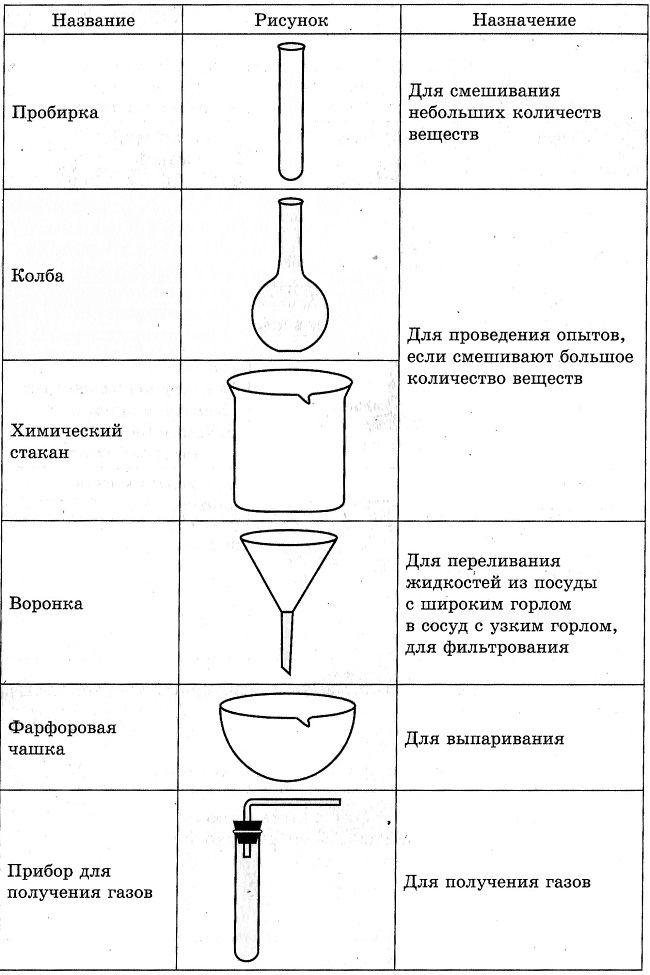
Ход работы:
- Правила ТБ
- Получение и собирание кислорода
- Горение угля и серы в кислороде
- Отчет о работе
Что делали | Что наблюдали | Выводы |
Практическая работа № 5
Приготовление растворов с определенной массовой долей растворенного вещества
Цель: закрепить полученные знания о массовой доле растворенного вещества, отработать навыки приготовления растворов с заданной концентрацией.
Оборудование урока: учебник, химическая посуда, весы лабораторные
Реактивы: вода, хлорид натрия, сульфат меди, карбонат кальция
Ход работы:
- Инструктаж по ТБ при проведении практической работы
- Произведение расчетов
- Взвешивание
- Приготовление раствора
- Отчет о выполнении работы выполняется в произвольной форме
Задания для практической работы:
Вариант 1
- Приготовьте 100 г раствора NaCl массовой долей 5 %
- Приготовьте 100 г раствора CuSO4 массовой долей 7 %
- Приготовьте 100 г раствора Ca CO3 массовой долей 10, 5%
Вариант 2.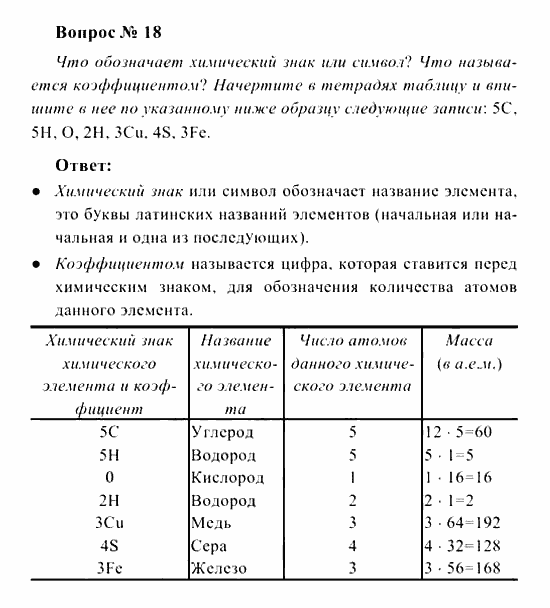
1. Приготовьте 100 г раствора NaCl массовой долей 9 %
2. Приготовьте 70 г раствора CuSO4 массовой долей 3 %
3. Приготовьте 20 г раствора Ca CO3 массовой долей 12, 3%
Вариант 3
1. Приготовьте 35 г раствора NaCl массовой долей 4 %
2. Приготовьте 100 г раствора CuSO4 массовой долей 2,5 %
3. Приготовьте 48 г раствора Ca CO3 массовой долей 13, 5%
Вариант 4
1. Приготовьте 115 г раствора NaCl массовой долей 3,2 %
2. Приготовьте 79 г раствора CuSO4 массовой долей 8 %
3. Приготовьте 108 г раствора Ca CO3 массовой долей 15%
Вариант 5
1. Приготовьте 50 г раствора NaCl массовой долей 3,2 %
2. Приготовьте 60 г раствора CuSO4 массовой долей 8 %
3. Приготовьте 30 г раствора Ca CO3 массовой долей 15%
Практическая работа № 6.
Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений»..jpg)
Цель: закрепить полученные знания об основных классах неорганических веществ отработать навыки написания уравнений реакций, умения делать выводы.
Оборудование: учебник, ПСХЭ, химическая посуда
Реактивы: соляная кислота гидроксид натрия, гидроксид меди, магний, оксид магния, хлорид меди
Ход работы:
- Инструктаж по ТБ при проведении практической работы
- Выполнение практической части.
- Решение задач № 1-5 вариант II
Оформить таблицу
Что делали | Что наблюдали | Выводы |
Задача№1 Определение соляной кислоты и гидроксида натрия, | Изменение окраски индикатора | Сформулировать вывод о изменении окраски используемых индикаторов |
Задача №2 Взаимодействие кислот и нерастворимых оснований | Растворение осадка | Написать уравнение реакции, сделать вывод |
Задача № 3 Определение раствора фенолфталеина | Изменение окраски индикатора | Сделать вывод |
Задача № 4 Получение хлорида магния используя имеющиеся реактивы | Написать уравнения реакций, сделать вывод |
Практическая работа № 6.
 (8). «Ионные реакции»
(8). «Ионные реакции»«Химия. 8 класс». О.С. Габриелян (гдз)
Опыт 1. «Обнаружение сульфат-ионов SO42– ».
Выполнение работы:
В одну пробирку налили раствор сульфата натрия, в другую — раствор сульфата калия и прибавили в каждую раствор хлорида бария. В обеих пробирках выпал белый мелкокристаллический осадок:
Для обнаружения ионов бария можно воспользоваться следующими реактивами:
Сущность обнаружения ионов с помощью реактива заключается в специфичности некоторых реакций, когда они сопровождаются разливными аналитическими сигналами: выделением газа или выпадением осадка определенного цвета.
Опыт 2. «Обнаружение хлорид-ионов Cl–»
Выполнение работы:
Уравнения диссоциации солей нитрата серебра и хлорида натрия:
AgNO3 ⇔ Ag+ + NO3–;
NaCl ⇔ Na
Нерастворимые хлориды серебра и свинца. Присутствие ионов Cl– в растворе хлорида натрия можно доказать при помощи нитрата серебра:
образуется белый творожистый осадок.
Опыт 3. «Обнаружение сульфат ионов SO42– и хлорид ионов Cl–»
Выполнение работы:
Для обнаружения в пробирках хлорида калия и сульфата магния воспользуемся следующим планом: Раствор из одной пробирки отлили в другую пробирку так, чтобы в каждой было примерно одинаковое количество раствора. В одну пробирку прильем немного раствора нитрата свинца (II), в другую раствор хлорида бария. Смотрим, в какой из пробирок выпал осадок, если в одной, то значит, здесь был раствор хлорида калия, если в двух — сульфат магния.
 Или наоборот. Тогда выпал осадок РbCl2, а сейчас выпал осадок РbSO4.
Или наоборот. Тогда выпал осадок РbCl2, а сейчас выпал осадок РbSO4.Опыт 4. Качественный состав хлорида бария, сульфата магния и карбоната аммония.
Выполнение работы:
а) Проделаем реакции, подтверждающие качественный состав ВаCl2.
Раствор из пробирки разделим пополам и перельем в 2 пробирки.
Докажем присутствие ионов Ва2+ — прильем в одну пробирку разбавленную серную кислоту, выпадает белый осадок:
BaCl
Докажем присутствие ионов Cl– — прильем в другую пробирку раствор нитрата серебра, выпадет белый осадок:
BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
б) Проделаем реакции, подтверждающие качественный состав MgSO4.
Раствор из пробирки разделим пополам и перельем в 2 пробирки.
Докажем присутствие ионов Mg2+ — прильем в одну пробирку раствор NаОН, выпадает белый осадок:
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2↓
Докажем присутствие нонов SO42– — прильем в другую пробирку раствор хлорида бария, выпадет белый осадок:
MgSO4 + BaCl2 = BaSO4↓ + MgCl2
в) Проведем реакции, подтверждающие качественный состав (NH4)2CO3.
Раствор из пробирки разделим пополам и перельем в две пробирки. Докажем присутствие ионов NH4+ прильем в пробирку раствор NаОН, почувствуем запах аммиака:
(NH4)2CO3 + 2NаОН = Na2CO3 + 2NH3↑ + 2H2O
Докажем присутствие ионов СО3– — прильем в пробирку раствор НСl, будет выделяться газ:
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O
8: Кислота, основания и pH (эксперимент)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 95543
- Колледж Санта-Моники
- Колледж Санта-Моники
Цели
- Для установки и демонстрации использования индикатора pH
- Для определения pH обычных растворов
- Чтобы понять разницу pH кислот и оснований
- Научиться пользоваться лабораторным рН-метром
- Чтобы понять взаимосвязь между pH и концентрацией ионов H+
Значение pH — это число, обычно от 0 до 14, которое представляет кислотность или щелочность раствора. +}\)) концентраций. 9+}\) концентрация ионов 10 -7 М.
+}\)) концентраций. 9+}\) концентрация ионов 10 -7 М.
Значения pH бытовых химикатов обычно варьируются от pH 0 до pH 14. Значения от 0 до 7 указывают на кислый раствор. Значения от 7 до 14 указывают на базовое решение. РН ровно 7 указывает на то, что раствор является нейтральным, ни кислым, ни щелочным. Чистая вода обычно имеет pH 7.
Шкала рН показана ниже.
Чем ниже значение pH, тем кислее раствор; чем выше значение pH, тем больше основное решение. Основные растворы также называют щелочными растворами . Следует отметить, что шкала pH выходит за пределы 0 и 14. Сильные лабораторные кислоты обычно имеют значения pH меньше 0 (отрицательные значения pH), а сильные лабораторные основания обычно имеют значения pH больше 14. Таким образом, они значительно более опасны.
Понятие рН широко используется во всех областях науки, включая сельское хозяйство, биологию, технику и медицину. Многие коммерческие продукты используют рН в качестве рекламного инструмента, например, шампунь и вода; совсем недавно еда и напитки с определенным pH рекламировались как более полезные для здоровья.
Индикатор pH — это вещество, которое при добавлении небольшого количества к раствору с неизвестным pH меняет свой цвет. Это способ определить pH раствора визуально. Индикатор, используемый в этой лаборатории, будет получен из природного источника, краснокочанной капусты. Индикатор капусты дает определенный цвет в зависимости от рН раствора. Индикаторы pH — это хороший способ легко и быстро показать приблизительное значение pH по цвету по сравнению со стандартом. Повседневный пример, когда используется индикатор pH, — это тестирование образца воды из плавательного бассейна. 9+}\) концентрации ионов. Показания прибора показывают точное значение рН исследуемого раствора.
pH-метры используются для измерения значений pH проб воды, например, для определения кислотности проб дождевой воды. Дождевая вода содержит растворенный углекислый газ, образующий слабокислый раствор. Дождь естественно имеет pH от 5 до 6. pH дождя в некоторых частях США меньше pH 5, что вредно для водной жизни и здоровья человека.
Буферную способность раствора проверяют добавлением небольших количеств кислоты (например, \(\ce{HCl}\)) и основания (например, \(\ce{NaOH}\)) и проверкой pH после каждое дополнение. Если рН меняется незначительно, раствор является хорошим буфером. Однако со временем его буферная способность будет исчерпана, и рН резко изменится.
Процедура
Материалы и оборудованиеХимический стакан на 400 мл, кольцевой штатив, проволочная сетка, горелка Бунзена, большие пробирки, пипетка-капельница, палочка для перемешивания, промывная бутыль с дистиллированной водой, лабораторный рН-метр, 0,1 М уксусная кислота, 0,1 М \(\ce{NaC2h4O2}\), 0,1 М уксусной кислоты (\(\ce{HC2h4O2}\)), 0,1 М соляной кислоты (\(\ce{HCl}\)), 0,1 М гидроксида натрия (\ (\ce{NaOH}\)), рН-бумага
Безопасность
Соблюдайте осторожность при использовании горелки Бунзена.
Средства индивидуальной защиты
Часть A: Приготовление индикатора pH и стандартов pH – ДЕМОНСТРАЦИЯ ДЛЯ ИНСТРУКТОРА
- Разорвите несколько листьев краснокочанной капусты на мелкие кусочки и поместите их в химический стакан на 500 мл. Добавьте в этот химический стакан примерно 500 мл дистиллированной воды. Убедитесь, что все кусочки листьев полностью погружены в воду.
- Осторожно кипятите смесь на нагревательной плите, пока она не приобретет темно-фиолетовый цвет (5–10 мин). Выключите огонь и дайте остыть (5 мин).
- Добавьте индикаторный раствор капусты к стандартным растворам pH, помеченным цифрами 1-13. Учащиеся записывают цвета стандартов pH.
- Каждая группа выносит небольшой стакан вперед и берет около 50 мл индикатора капусты на свое рабочее место.

Часть B: Качественный анализ значений pH бытовых химикатов
- Возьмите 10 больших пробирок (чистых, но могут быть влажными). Пометьте каждую пробирку тестируемыми растворами.
- Налейте около 3 мл каждого раствора в пробирку с соответствующей маркировкой.
- С помощью пипетки добавьте равный объем индикаторного раствора капусты. При необходимости перемешайте чистой палочкой для перемешивания (между применениями промывайте дистиллированной водой).
- Запишите полученный цвет образца после смешивания с индикатором капусты. Сравните этот цвет со стандартами pH в передней части лаборатории, чтобы определить pH образца. Цвет может быть между стандартными цветами pH (например, зелено-голубой вместо одного только зеленого или синего). Для них запишите значения pH до 0,5 (например, pH = 9)..5 вместо 9 или 10).
Примечание
Не выбрасывайте содержимое этих пробирок, поскольку оно будет использоваться в следующем разделе.
Часть C: Количественный анализ значений pH бытовых химикатов
- Вставьте зонд в один порт на боковой стороне pH-метра. Подключите адаптер переменного тока к другой стороне рН-метра; подключите адаптер к электрической розетке. Вы должны увидеть значение pH.
- Подготовьте зонд к измерению pH: выньте его из бутыли для хранения и тщательно промойте нижнюю часть зонда дистиллированной водой/промывочной бутылью.
Примечание: Не погружайте зонд полностью. Ручка не является водонепроницаемой.
- Используйте те же десять пробирок с образцами из части B. Или выполните шаги 1 и 2 части B, чтобы получить десять образцов для анализа. Вставьте pH-зонд непосредственно в каждую пробирку. ОСОБАЯ ОСТОРОЖНОСТЬ НЕОБХОДИМА ПРИ ВСТАВКЕ ЗОНДОВ В ПРОБИРКИ. Зонды НЕ должны касаться стеклянного ободка пробирок, иначе можно легко сломать пузырек pH и повредить зонд.
- Запишите значение pH (до 0,01 pH), отображаемое на экране pH-метра.

- После каждого измерения pH зонд необходимо тщательно промыть дистиллированной водой.
- По окончании измерений промойте датчик дистиллированной водой. Наденьте колпачок на зонд, а затем завинтите колпачок на бутыль для хранения так, чтобы наконечник зонда был погружен в раствор для хранения.
Часть D: Влияние буферов на pH
- Возьмите 4 большие пробирки. Пометьте пробирки A, B, C и D.
- Добавьте 10 мл дистиллированной воды в пробирки A и C.
- Добавьте по 5 мл 0,1 М H \(\ce{C2h4O2}\) (уксусная кислота) и 0,1 M \(\ce{NaC2h4O2}\) (ацетат натрия) в пробирки B и D. Эта смесь уксусной кислота и ацетат натрия — буферный раствор. Перемешайте, чтобы полностью перемешать.
- Используя индикаторную бумагу, определите рН содержимого каждой пробирки (A-D). С помощью палочки для перемешивания нанесите небольшую каплю тестируемого раствора на бумагу для определения pH. Затем сравните полученный цвет со шкалой pH на столе инструктора, чтобы определить значение pH.
 Запишите эти значения pH до 0,1
Запишите эти значения pH до 0,1 - Добавьте 5 капель 0,1 М (\ce{HCl}\) (соляная кислота) в пробирки A и B. Запишите значение pH с помощью индикаторной бумаги.
- Добавьте 5 капель 0,1 М \(\ce{NaOH}\) (гидроксида натрия) в пробирки C и D. Запишите значение pH с помощью индикаторной бумаги.
Лабораторный отчет: Кислоты, основания и pH
Часть A: Индикатор цвета краснокочанной капусты со стандартами pH
pH-стандарт | Цвет с индикатором капусты |
|---|---|
1 | |
2 | |
3 | |
4 | |
5 | |
6 | |
7 | |
8 | |
9 | |
10 | |
11 | |
12 |
Части B и C: рН бытовой химии
Химическая промышленность | Цветной с индикатором | Качественный рН (до 0,5) | Кислотный, основной или нейтральный? | Количественный pH (до 0,01) |
|---|---|---|---|---|
сода | 5)»> | |||
шампунь | ||||
очиститель аммиака | ||||
отбеливатель | 5)»> | |||
стиральный порошок | ||||
лимонный сок | ||||
уксус | 5)»> | |||
вода в бутылках | ||||
0,1 М \(\ce{HCl}\) | ||||
0,1 М \(\ce{NaOH}\) | 5)»> |
Часть D: Влияние буферов на рН
Трубка
Содержимое
Начальный рН
Химическая добавка
Новый pH
Изменение pH
А
Вода
\(\ce{HCl}\)
Б
Буферный раствор
(уксусная кислота и ацетат натрия)
\(\ce{HCl}\)
С
Вода
\(\ce{NaOH}\)
Д
Буферный раствор
(уксусная кислота и ацетат натрия)
\(\ce{NaOH}\)
Вопросы
- Что такое кислый раствор? Что такое базовое решение?
- Что такое щелочной раствор? 9+}\)] = _________________
- Два метода определения значений pH (индикатор pH и pH-метр) должны давать одинаковые значения pH для этих растворов.
 Что отличалось?
Что отличалось? - Объясните, почему дождь естественно кислотный, но не все дожди классифицируются как «кислотные дожди».
- Вот примеры того, что человек может сделать, чтобы уменьшить количество кислотных дождей. Для каждого объясните связь с образованием кислотных дождей.
- избегать запуска стиральной машины с небольшой загрузкой
- добавить дополнительную изоляцию на бытовой водонагреватель
- ходить пешком вместо того, чтобы ездить на работу
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Колледж Санта-Моники
- Лицензия
- CC BY-NC
- Показать страницу TOC
- № на стр.

- Теги
- CO 2 + H 2 O → C 6 H 12 O 6 + O 2
- SiCl 4 + H 2 O → H 4 SiO 4 + HCl
- Al + HCl → AlCl 3 + H 2
- Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2
- C 7 H 6 O 2 + O 2 → CO 2 + H 2 О
- Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe(OH) 3
- Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3
- KClO 3 → KClO 4 + KCl
- Al 2 (SO 4 ) 3 + Ca(OH) 2 → Al(OH) 3 + CaSO 4
- Ч 2 SO 4 + HI → H 2 S + I 2 + H 2 O
Эта страница под заголовком 8: Acid, Bases and pH (Experiment) опубликована в соответствии с лицензией CC BY-NC и была создана, изменена и/или курирована Колледжем Санта-Моники.
Уравновешивание химических уравнений: практика и повторение
Из всех навыков, которые необходимо знать в химии, уравновешивание химических уравнений является, пожалуй, наиболее важным для освоения. Очень многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и работу в лаборатории. Это подробное руководство покажет вам, как сбалансировать даже самые сложные реакции, и проведет вас через серию примеров, от простых к сложным.
Заинтересованы в лицензии школы Альберта?
Ключ к балансировке химических уравнений
Конечная цель балансировки химических уравнений — сделать обе стороны реакции, реагенты и продукты, равными по количеству атомов на элемент. Это вытекает из универсального закона сохранения массы, который гласит, что материя не может быть ни создана, ни уничтожена. Итак, если мы начинаем с десяти атомов кислорода до реакции, нам нужно получить десять атомов кислорода после реакции. Это означает, что химические реакции не изменяют фактические строительные блоки материи; скорее, они просто меняют расположение блоков. Простой способ понять это — представить себе дом из блоков. Мы можем разбить дом и построить самолет, но цвет и форма самих блоков не изменятся.
Итак, если мы начинаем с десяти атомов кислорода до реакции, нам нужно получить десять атомов кислорода после реакции. Это означает, что химические реакции не изменяют фактические строительные блоки материи; скорее, они просто меняют расположение блоков. Простой способ понять это — представить себе дом из блоков. Мы можем разбить дом и построить самолет, но цвет и форма самих блоков не изменятся.
Но как сбалансировать эти уравнения? Мы знаем, что количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения, поэтому для этого достаточно найти правильные коэффициенты (числа перед каждой молекулой). Лучше всего начать с атома, который встречается наименьшее количество раз с одной стороны, и сбалансировать его первым. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце обязательно еще раз подсчитайте количество атомов каждого элемента с каждой стороны, просто для уверенности.
Исследуйте баланс химических уравнений на Альберте
Пример баланса химического уравнения
Давайте проиллюстрируем это на примере, балансируя это химическое уравнение:
P 4 O 10 907 O 7 3 Заказ на покупку 4
Сначала рассмотрим элемент, который встречается реже всего. Обратите внимание, что кислород встречается дважды слева, так что это не лучший элемент для начала. Мы могли бы начать либо с фосфора, либо с водорода, так что давайте начнем с фосфора. В левой части четыре атома фосфора, а в правой — только один. Таким образом, мы можем присвоить коэффициент 4 молекуле с фосфором в правой части, чтобы сбалансировать их.
Обратите внимание, что кислород встречается дважды слева, так что это не лучший элемент для начала. Мы могли бы начать либо с фосфора, либо с водорода, так что давайте начнем с фосфора. В левой части четыре атома фосфора, а в правой — только один. Таким образом, мы можем присвоить коэффициент 4 молекуле с фосфором в правой части, чтобы сбалансировать их.
P 4 O 10 + H 2 O → 4 H 3 PO 4
Теперь мы можем проверить водород. Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он встречается более чем в одной молекуле с левой стороны. Легче всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, слева две молекулы водорода, а справа двенадцать (обратите внимание, что на молекулу H 3 PO 4 приходится по три молекулы, а у нас четыре молекулы). Итак, чтобы сбалансировать их, мы должны поставить шестерку перед H 9.0776 2 О слева.
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
На этом этапе мы можем проверить баланс кислорода. Слева у нас есть десять атомов кислорода от P 4 O 10 и шесть от H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами ). Итак, кислород уже уравновешен. Это дает нам окончательное сбалансированное уравнение
Слева у нас есть десять атомов кислорода от P 4 O 10 и шесть от H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами ). Итак, кислород уже уравновешен. Это дает нам окончательное сбалансированное уравнение
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
Заинтересованы в лицензии школы Albert?
Уравновешивание химических уравнений Практические задачиПопробуйте сбалансировать эти десять уравнений самостоятельно, а затем проверьте ответы ниже. Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся слишком сложными. Просто не забудьте начать с элемента, который отображается меньше всего, и продолжить оттуда. Лучший способ подходить к этим проблемам — медленно и систематически. Глядя на все сразу, легко можно утомиться. Удачи!
Исследуйте балансирующие химические уравнения на Альберте
Полные растворы:
1. CO 2 + H 2 O → C 6 + О 2
CO 2 + H 2 O → C 6 + О 2 Первый шаг к балансировке химических уравнений — сосредоточиться на элементах, которые появляются только один раз в каждой части уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. В левой части всего один атом углерода, а в правой — шесть. Итак, к углеродсодержащей молекуле слева прибавляем коэффициент шесть.
6CO 2 + H 2 O → C 6 H 12 O 6 + O 2
Далее рассмотрим водород. Два атома водорода слева и двенадцать справа. Итак, добавим коэффициент шесть к водородосодержащей молекуле слева.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + O 2
Теперь пора проверить кислород. Всего слева 18 молекул кислорода (6×2 + 6×1). Справа восемь молекул кислорода. Теперь у нас есть два варианта выравнивания правой части: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент. Однако если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
Однако если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2 7
4
90. + Н 2 О → Н 4 SiO 4 + HCl Единственный элемент, который встречается здесь более одного раза в одной и той же части уравнения, — это водород, поэтому мы можем начать с любого другого элемента. Начнем с кремния. Обратите внимание, что с каждой стороны находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
SiCl 4 + H 2 O → H 4 SiO 4 + 4HCl
Теперь давайте посмотрим на кислород. Помните, что сначала мы хотим проанализировать все элементы, которые встречаются только один раз на одной стороне уравнения. Слева всего один атом кислорода, а справа четыре. Итак, мы добавим коэффициент четыре в левой части уравнения.
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Мы почти закончили! Теперь нам просто нужно проверить количество атомов водорода с каждой стороны. У левого есть восемь, и у правого также есть восемь, так что мы закончили. Наш окончательный ответ
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Как всегда, убедитесь, что количество атомов каждого элемента сбалансировано с каждой стороны, прежде чем продолжить.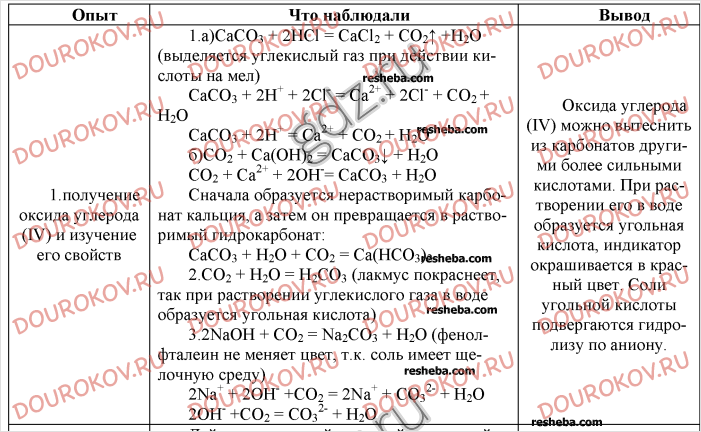
Эта задача немного сложна, так что будьте осторожны. Всякий раз, когда один атом находится в одиночестве по обе стороны уравнения, проще всего начать с этого элемента. Итак, мы начнем с подсчета атомов алюминия с обеих сторон. Есть один слева и один справа, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на водород. Слева тоже один, а справа два. Итак, мы добавим коэффициент два слева.
Al + 2HCl → AlCl 3 + H 2
Далее мы рассмотрим хлор. Слева теперь двое, а справа трое. Теперь это не так просто, как просто добавить коэффициент к одной стороне. Нам нужно, чтобы количество атомов хлора было одинаковым с обеих сторон, поэтому нам нужно, чтобы два и три были равны. Мы можем сделать это, найдя наименьшее общее кратное. В этом случае мы можем умножить два на три и три на два, чтобы получить наименьшее общее кратное шести. Итак, умножим 2HCl на три и AlCl 3 на два:
Итак, умножим 2HCl на три и AlCl 3 на два:
Al + 6HCl → 2AlCl 3 + H 2
Мы рассмотрели все элементы, поэтому легко сказать, что мы закончили. Тем не менее, всегда обязательно перепроверяйте. В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий, в правой части, алюминий больше не сбалансирован. Слева один, а справа два. Итак, добавим еще один коэффициент.
2Al + 6HCl → 2AlCl 3 + H 2
Мы еще не совсем закончили. Просматривая уравнение в последний раз, мы видим, что водород также был несбалансирован. Слева шесть, а справа два. Итак, с последней корректировкой, мы получаем наш окончательный ответ:
2Al + 6HCl → 2AlCl 3 + 3H 2
4. Na 2 CO 7 277 + HCl0 6 NaCl0 O + CO 2 Будем надеяться, что к этому моменту балансировка уравнений станет проще, и вы освоитесь. Глядя на натрий, мы видим, что он встречается дважды слева и один раз справа. Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Na 2 CO 3 + HCl → 2NaCl + H 2 O + CO 2
Теперь давайте посмотрим на углерод. Один слева и один справа, поэтому коэффициенты добавлять не нужно. Так как кислород встречается более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Слева один и справа два, поэтому добавим коэффициент слева.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Потом, глядя на хлорку, мы видим, что она уже уравновешена двумя с каждой стороны. Теперь мы можем вернуться к кислороду. Три слева и три справа, поэтому наш окончательный ответ:
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Заинтересованы в школе Альберта лицензия?
5. C 7 H 6 O 2 + O 2 → CO 2 + H 2 O Мы можем начать балансировку этого уравнения, взглянув либо на углерод, либо на водород. Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + H 2 O
Затем слева шесть атомов, для водорода есть шесть. Итак, мы добавим коэффициент три справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + 3H 2 O
Теперь по кислороду будет немного посложнее. Кислород присутствует в каждой молекуле уравнения, поэтому мы должны быть очень осторожны при его балансировании. Четыре атома кислорода слева и 17 справа. Не существует очевидного способа сбалансировать эти числа, поэтому мы должны использовать небольшую хитрость: дроби. Теперь при балансировке химических уравнений мы не можем включать дроби, так как это неправильная форма, но иногда их использование помогает решить задачу. Кроме того, старайтесь избегать чрезмерного манипулирования органическими молекулами.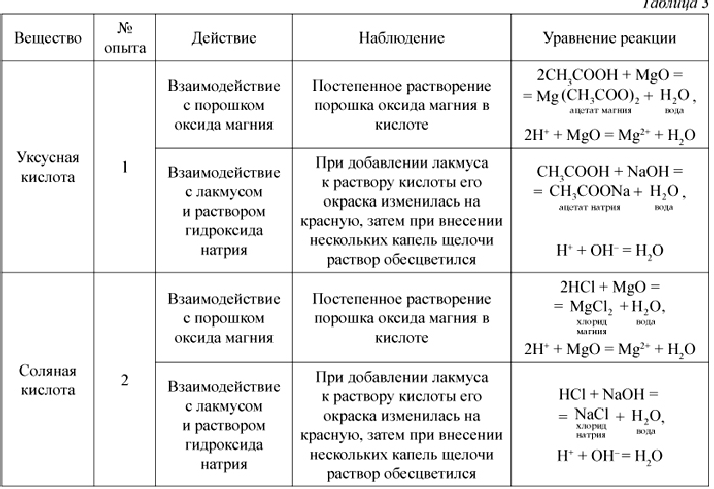 Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Итак, чтобы сбалансировать четыре и семнадцать, мы можем умножить O 2 слева на 7,5. Это даст нам
C 7 H 6 O 2 + 7.5O 2 → 7CO 2 + 3H 2 O
4 90 в формальном сбалансированном уравнения, поэтому умножьте все на два, чтобы получить целые значения. Теперь наш окончательный ответ:
2C 7 H 6 O 2 + 15O 2 → 14CO 2 + 6H 2 O
6. Fe 2 (SO 4 ) 3 + KOH → 7 7 7 907 4 2 99 7 + Fe(ОН) 3- Начнем с балансировки утюга с обеих сторон. У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + 2Fe(OH) 3-
Затем мы можем посмотреть на серу. Слева их три, а справа только один. Итак, мы добавим коэффициент три в правую часть.
Fe 2 (SO 4 ) 3 + KOH → 3K 2 SO 4 + 2Fe(OH) 3-
4 Почти готово 900. Осталось только сбалансировать калий. Слева один атом, а справа шесть, поэтому мы можем сбалансировать их, добавив коэффициент шесть. Таким образом, наш окончательный ответ равен 9.0034
Fe 2 (SO 4 ) 3 + 6KOH → 3K 2 SO 4 + 2Fe(OH) 3- 7 6 Ca 9,0324 90 76 3 (ПО 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3 Глядя на кальций, мы видим, что их три слева и один справа, поэтому мы можем добавить коэффициент из трех справа, чтобы сбалансировать их. Ca 3 (ПО 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3 Тогда для фосфора мы видим, что их два слева и четыре справа. Чтобы сбалансировать их, добавьте коэффициент два слева. 2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 1 3
2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 6CaSiO 1 9073 в каждой молекуле в уравнении, мы пропустим это на данный момент. Ориентируясь на кремний, мы видим, что слева он один, а справа шесть, поэтому мы можем добавить коэффициент слева.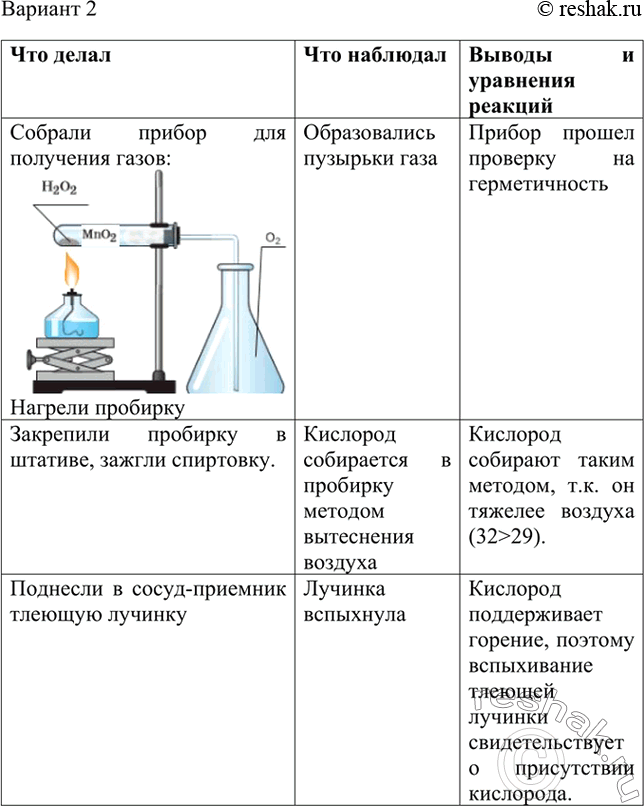
2Ca 3 (ПО 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3 97760777
Теперь проверим количество атомов кислорода с каждой стороны. В левой части 28 атомов, а в правой тоже 28. Итак, после проверки того, что все остальные атомы одинаковы с обеих сторон, мы получаем окончательный ответ
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
8. KClO 7 KCl 3 → KClO 977 + 6 4 0033Эта задача особенно сложна, потому что каждый атом, кроме кислорода, , встречается в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, с него и начнем. Их три слева и четыре справа. Чтобы сбалансировать их, мы находим наименьшее общее кратное; в данном случае 12. Добавляя коэффициенты четыре слева и три справа, мы можем сбалансировать кислород.
4KClO 3 → 3KClO 4 + KCl
Теперь мы можем проверить калий и хлор. Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также уравновешен, по четыре с каждой стороны, поэтому мы закончили, с окончательным ответом
Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также уравновешен, по четыре с каждой стороны, поэтому мы закончили, с окончательным ответом
4KClO 3 → 3KClO 4 + KCl
9. Al 2 7 (SO 7 6 7 6 4 ) 3 + Ca(OH) 2 → Al(OH) 3 + CaSO 4Здесь мы можем начать с балансировки атомов алюминия с обеих сторон. Слева две молекулы, а справа только одна, поэтому мы добавим коэффициент два справа.
Al 2 (SO 4 ) 3 + Ca(OH) 2 → 2Al(OH) 3 + CaSO 4
Ал 2 (SO 4 ) 3 + Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
Двигаясь прямо к кальцию, слева только один, а справа три правильно, поэтому мы должны добавить коэффициент три.
Al 2 (SO 4 ) 3 + 3Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
4 в элементы сбалансированы, поэтому наше окончательное уравнение равно
Al 2 (SO 4 ) 3 + 3Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4 90,10329 0,10324 0776 2 СО 4 + HI → H 2 S + I 2 + H 2 O
Поскольку водород встречается более одного раза слева, мы временно пропустим его и перейдем к сере. Один атом слева и один справа, так что балансировать пока нечего. Глядя на кислород, четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы сбалансировать их.
H 2 SO 4 + HI → H 2 S + I 2 + 4H 2 O
Иод только один слева и два справа, поэтому простой коэффициент может уравновесить тех.
H 2 SO 4 + 2HI → H 2 S + I 2 + 4H 2 O
Теперь мы можем взглянуть на самый сложный элемент: водород.


 ( сделать рисунок, определить основные части пламени, сделать вывод.
( сделать рисунок, определить основные части пламени, сделать вывод.

 Запишите эти значения pH до 0,1
Запишите эти значения pH до 0,1 Что отличалось?
Что отличалось?