Химический практикум – разработки уроков по химии – Корпорация Российский учебник (издательство Дрофа – Вентана)
Автор: Лаптева Евгения Павловна, учитель химии МАОУ «Лицей №4» муниципального образования города Чебоксары, Чувашская Республика
Пояснительная записка
Программа курса по выбору предназначается для учащихся 9 класса и рассчитана на 34 часа в год, 1ч в неделю.
Рабочая программа составлена на основании:
- Федерального закона от 29.12.12г. №273 Ф.З. «Об образовании в Российской Федерации»;
- Федерального компонента государственного стандарта основного общего образования;
- Программы Министерства образования Российской Федерации от 30.08.13г. №1015 «Об утверждении Порядка организации и осуществлении образовательной деятельности по основным общеобразовательным программам основного общего образования»;
- Примерной программы для общеобразовательных учреждений.
 Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008.
Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008.
Целью данного курса является: помочь ученикам сориентироваться в химико-биологическом профиле и прививать практические навыки работы в химической лаборатории.
Данный курс не дублирует школьную программу, а способствует формированию умений и навыков практической работы, развивает способности учащихся и укрепляет их желание посвятить себя работе по химической специальности.
Учащиеся экспериментальным путем знакомятся с составом веществ и их химическими свойствами, приобретают определенные умения и навыки выполнения различных химических операций (смешивание, измельчение, растворение веществ, нагревание, фильтрование, титрование и т.д.), причем все выполняют своими руками, что укрепляет их интерес к предмету.
Большое значение для развития интереса учащихся к химии, которая является, прежде всего, экспериментальной наукой, имеют самостоятельные практические работы учащихся.
Для приобретения практических навыков и повышения уровня знаний предусматривается выполнение проектной работы и итоговой контрольной работы, практических (15 уроков) работ. Рабочая программа для 9 класса предусматривает обучение химии 1 часа в неделю (34 часа в год) из них 2 резервных часа.
В рамках данной программы использованы две формы обучения: лекционно-семинарские и практические работы.
При формировании понятий курса следует учитывать, что учащиеся затрагивают межпредметную связь. Например: природоведение, биологию, географию, трудовое обучение, физику. Поэтому, в конце курса предусмотрено выполнение проектных работ с использованием местного материала, например: исследование качества водопроводной воды, или, определение загрязнителей в снежном покрове и т.д.
После изучения курса учащиеся должны уметь характеризовать свойства веществ на основе теоретических представлений, зависимость получений и применения веществ от их внутренней структуры, а также правильное обращение с химической посудой и реактивами.
Результаты обучения оцениваются по зачетной системе при выполнении ими химического эксперимента, где рассматривается глубина, осознанность, полнота выполняемого эксперимента.
Курс может быть оценен положительно, если ученик:
- проделал 90 % практических работ;
- выполнил итоговую контрольную работу не менее 60%;
- активно участвовал в работе.
Формы контроля ЗУН:
- беседа (на каждом уроке для формирования умения учащихся грамотно говорить, используя хим. термины и понятия) + индивидуальный опрос;
- письменный тестовый зачет по каждой теме;
- зашита проектных работ;
Форма промежуточной аттестации: итоговая контрольная работа.
Содержание разделов учебного предмета
(34 часа, 1 час в неделю)
Раздел 1. Введение. (3 часа)
Тема 1.1. Место химии среди естественных наук. (1 час)
(1 час)
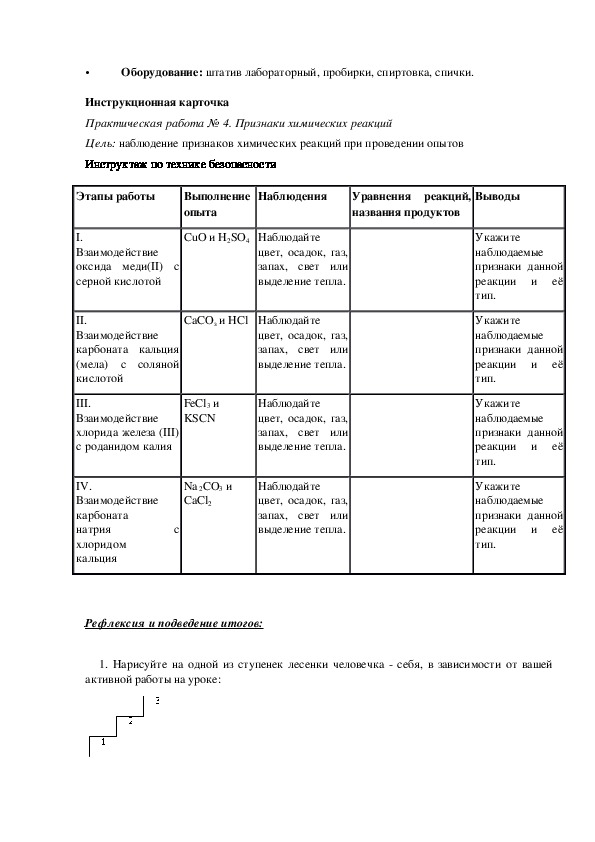
Инструктаж по ТБ. Первая помощь при ожогах, отравлениях, порезах.
Тема 1.2. Практическая работа (2 часа)
ПР № 1. Знакомство с лабораторным оборудованием. Правила ТБ в лаборатории.
ПР №2. Чистые вещества и смеси. Методы разделения смесей.
Раздел 2. Основы химического анализа. (12 часов)
Тема 2.1. Ионы. (5 часов)
Классификация катионов по кислотно-щелочной схеме анализа.
Тема 2.2. Анализ различных объектов. (5 часов)
Определение качества воды. Определение нитратов, катионов тяжелых металлов.
Тема 2.3. Выход продукта реакции. (2 часа)
Решение задач на определение выхода продукта реакции.
ПР№3-9
Раздел 3. Неметаллы и их соединения. (7 часов)
Тема 3.1. Азот и его соединения. (1час)
ПР№10Азот, аммиак, соли аммония. Определение солей аммония.
Тема 3.2. Водород и его свойства.(3 часа)
Окислительно-восстановительные свойства водорода. Получение мыльных пузырей.
Тема 3.2. Решение экспериментальных задач.(3 часа)
ПР№10-13
Раздел 4. Общие свойства металлов. (7 часов)
Тема 7.1. Окислительные свойства соединений металлов.( 3 часа)
Окислительные свойства бихромата и перманганата калия.
Тема 7.2. Амфотерность.(4часа)
Амфотерные оксиды и гидроксиды. Получение и свойства.
ПР№14-15
Раздел 5. Определение предметных компетентностей. (3 часа)Тема 5.1. Решение экспериментальных задач.
Итоговая контрольная работа.
Резерв (2ч)
Требования к уровню подготовки учащихся
В результате изучения химии в 9 классе ученик должен знать/ понимать:
- Хим.
 символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций;
символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций; - Важнейшие хим.понятия: хим.элемент, атом, молекула, относительные атомная и молекулярная массы, ион, хим. Связь, вещество, классификация веществ, моль, молярная масса, молярный объем, хим.реакция, классификация реакций, степень окисления, валентность, окислитель и восстановитель, окисление и восстановление, электорлит и неэлектролит, электролитическая диссоциация;
- Основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
Уметь:
- Называть хим. элементы, соединения изученных классов;
- Объяснять физический смысл атомного (порядкового) номера хим.элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе элементов Д.И.Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
- Характеризовать хим.
 элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ;
элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ; - Определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы хим.реакций, валентность и степень окисления, вид хим.связи в соединениях, возможность протекания реакций ионного обмена;
- Составлять: формулы неорганических соединений; схемы строения атомов первых 20 элементов периодической системы элементов Д.И.Менделеева; уравнения хим.реакций;
- Обращаться с хим. посудой и лабораторным оборудованием;
- Распознавать: опытным путем кислород, водород, растворы кислот и щелочей, хлорид-, сульфат-, карбонат — ионы;
- Вычислять: массовую долю хим.элемента в веществе, массовую долю вещества в растворе, количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни с целью:
- Безопасного обращения с веществами и материалами;
- Экологически грамотного поведения в окружающей среде;
- Оценки влияния хим.

- Критической оценки информации о веществах, используемых в быту;
- Приготовления растворов заданной концентрации.
Календарно-тематическое планирование
|
№ |
Сроки (месяц) |
Тема урока |
Тип урока с указанием лабораторных, практических, контрольных работ |
Вид и форма контроля за уровнем усвоенного |
НРК |
|
Введение ( 3 ч) |
|||||
|
1 |
Сентябрь |
Место химии среди естественных наук. |
Урок повторения и обобщения |
|
|
|
2 |
Сентябрь |
ПР № 1. Знакомство с лабораторным оборудованием. Правила ТБ при работе в хим. лаборатории. |
Урок применения знаний и умений |
Практическая работа |
|
|
3 |
Сентябрь |
ПР №2. |
Урок применения знаний и умений |
Практическая работа |
|
|
Основы химического анализа (12 ч) |
|||||
|
4. |
Сентябрь |
Ионы. Классификация катионов по кислотно-щелочной схеме анализа. |
Урок ознакомления с новым материалом |
|
|
|
5. |
октябрь |
ПР № 3. Катионы и опыты с ними. |
Урок применения знаний и умений |
Практическая работа |
|
|
6. |
октябрь |
ПР№4. Качественный анализ на катионы. |
Урок применения знаний и умений |
Практическая работа |
|
|
7. |
октябрь |
Использование реакций осаждения в качественном анализе. Групповые, селективные реакции анионов. |
Урок ознакомления с новым материалом |
|
|
|
8. |
октябрь |
ПР№5. Групповые, селективные реакции анионов. |
Урок применения знаний и умений |
Практическая работа |
|
|
9. |
октябрь |
Анализ реальных объектов: «Сухая задача». |
Урок ознакомления с новым материалом |
|
|
|
10. |
Ноябрь |
ПР№6.Анализ вещества или смеси двух веществ. |
Урок применения знаний и умений |
Практическая работа |
|
|
11. |
Ноябрь |
Определение качества воды. |
Урок ознакомления с новым материалом |
|
ОАО «Водоканал» |
|
12. |
Ноябрь |
ПР№7.Определение нитратов и нитритов, катионов тяжелых металлов в воде. |
Урок применения знаний и умений |
Практическая работа |
|
|
13. |
Декабрь |
ПР№8.Капельный анализ с полуколичественным определением ионов железа в природной воде. |
Урок применения знаний и умений |
Практическая работа |
|
|
14. |
Декабрь |
ПР№9.Определение выхода продукта реакции. |
Урок применения знаний и умений |
Практическая работа |
|
|
15. |
Декабрь |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
|
|
Неметаллы и их соединения (7 ч) |
|||||
|
16. |
Декабрь |
ПР№10.Азот, аммиак, соли аммония. Определение солей аммония. |
Урок применения знаний и умений |
Практическая работа |
|
|
17-18. |
Январь |
Окислительно-восстановительная двойственность водорода. |
Урок ознакомления с новым материалом |
|
|
|
19. |
Январь |
ПР№ 11. Водород как окислитель и восстановитель. |
Урок применения знаний и умений |
Практическая работа |
|
|
20. |
Февраль |
Решение экспериментальных задач по по теме «Подгруппа кислорода» |
Урок ознакомления с новым материалом |
|
|
|
21. |
Февраль |
Решение экспериментальных задач по по теме «Подгруппа углерода» |
Урок применения знаний и умений |
Практическая работа |
|
|
22. |
Февраль |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
|
|
Общие свойства металлов (7ч) |
|||||
|
23, 24 |
Февраль ,Март |
Изучение ОВР процессов на примере перманганата и бихромата калия. |
Урок ознакомления с новым материалом |
|
|
|
25. |
Март |
ПР№14. Опыты с перманганатом калия. |
Урок применения знаний и умений |
Практическая работа |
|
|
26,27 |
март |
Изучение свойств амфотерных соединений. |
Урок ознакомления с новым материалом |
|
|
|
28. |
Апрель |
ПР№ 15.Получение амфотерного гидроксида и изучение его свойств. |
Урок применения знаний и умений |
Практическая работа |
|
|
29. |
Апрель |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
|
|
Определение предметных компетентностей (3 ч) |
|||||
|
30. |
Апрель |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
На основе региональных данных |
|
31. |
Май |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
На основе региональных данных |
|
32. |
Май |
Итоговая контрольная работа. |
Урок применения знаний и умений |
|
|
|
Резерв (2 ч) |
|||||
|
33. |
Май |
Обобщение и повторение. |
|
|
|
|
34. |
май |
Обобщение и повторение. |
|
|
|
Практические работы по химии (9 класс) | Химия
Автор: Фаттахова Галина Александровна
Организация: МБОУ «Мари-Турекская СОШ»
Населенный пункт: Республика Марий Эл, пгт. Мари-Турек
Практическая работа №1.
Влияние различных факторов на скорость химической реакции
Цель: изучение условий, влияющих на скорость химической реакции.
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций;
- Ответьте на вопросы;
- Сделайте общий вывод по окончании практической работы;
- Сделайте фото работы и отправьте его на адрес электронной почты учителю.

|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
|
Как определить реакцию способность металлов и галогенов по периодической таблице химических элементов Д.И.Менделеева? |
|
|||
|
|
|
|
Во сколько раз изменяется скорость реакции при повышении температуры? |
|
|||
|
|
|
|
Почему при увеличении концентрации реагента возрастает скорость реакции? |
|
|||
|
|
|
|
Что такое катализатор? Что такое ингибитор? Что такое фермент? |
Вывод:
Практическая работа №2.
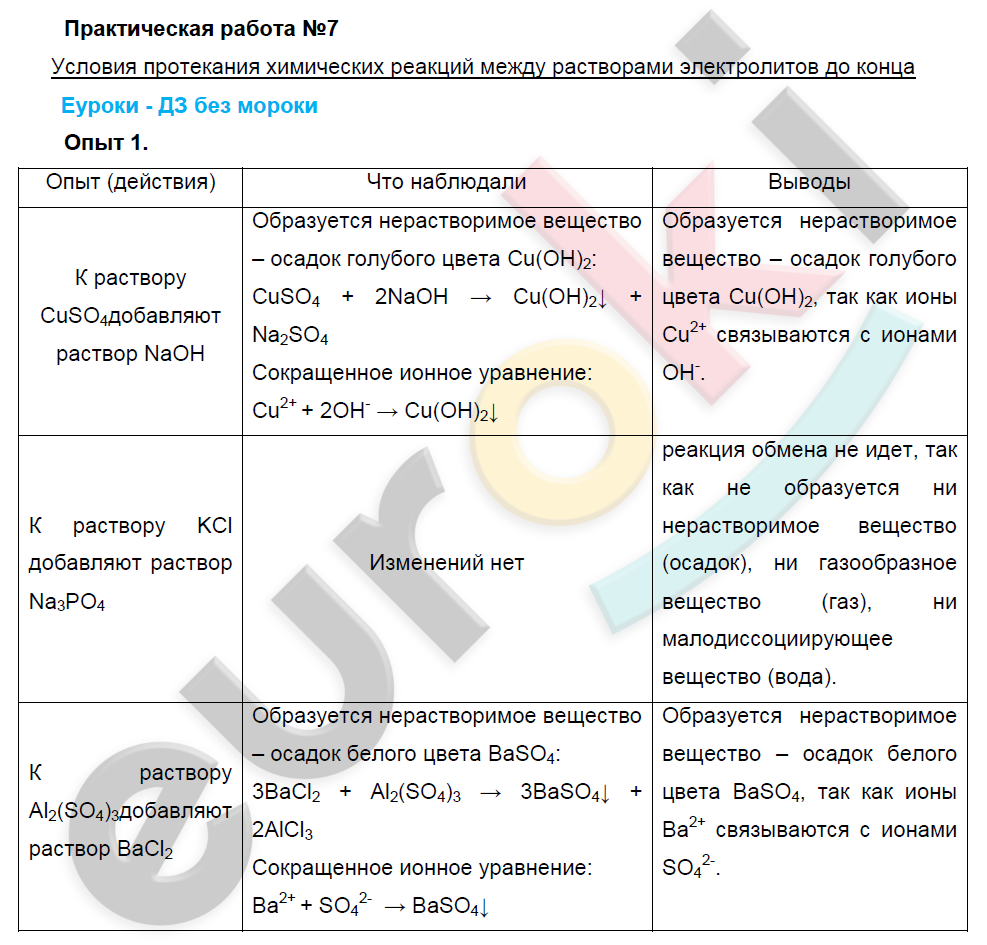
Решение экспериментальных задач по теме
«Растворы. Электролитическая диссоциация»
Цель: изучение условий прохождения реакций ионного обмена до конца; закрепление умения пользоваться таблицей растворимости кислот, оснований и солей.
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций в молекулярном, полном и сокращенном ионных видах;
- Ответьте на вопросы;
- Сделайте общий вывод по окончании практической работы;
- Сделайте фото работы и отправьте его на адрес электронной почты учителю.
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Напишите первое условие протекания реакции ионного обмена до конца |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Напишите второе условие протекания реакции ионного обмена до конца |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Напишите третье условие протекания реакции ионного обмена до конца |
Вывод:
Практическая работа №3.
Получение аммиака и изучение его свойств
Цель: рассмотреть способ получения аммиака в лаборатории; изучить его основные свойства; составить уравнения химических реакций, подтверждающие свойства аммиака
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций
- Ответьте на вопросы
- Сделайте общий вывод по окончании практической работы
- Сделайте фото работы и отправьте его на адрес электронной почты учителю
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Из каких веществ получают аммиак в лаборатории? Каким способом собирают аммиак и почему? |
|
|||
|
|
|
Рассмотрите с точки зрения окислительно-восстановительной реакции |
Влияют ли условия проведения реакции на образующееся продукты? |
|
|||
|
|
|
|
Какова растворимость аммиака в воде? Какой тип свойств характерен аммиаку? |
|
|||
|
|
|
|
Что такое донорно-акцепторный механизм протекания реакции? Донором или акцептором является аммиак? |
Вывод:
Практическая работа №4.
Получение оксида углерода (IV) и изучение его свойств
Цель: рассмотрение способа получения аммиака в лаборатории; изучение его основных свойств; составление уравнений химических реакций, подтверждающих свойства аммиака
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций
- Ответьте на вопросы
- Сделайте общий вывод по окончании практической работы
- Сделайте фото работы и отправьте его на адрес электронной почты учителю
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Из каких веществ получают углекислый газ в лаборатории? Каким способом собирают углекислый газ и почему? |
|
|||
|
|
|
|
Объясните, почему углекислый газ не поддерживает горение. |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
При каких условиях образуется кислая соль? |
|
|||
|
|
|
|
Объясните наблюдаемый процесс |
|
|||
|
|
|
Рассмотрите с точки зрения окислительно-восстановительной реакции |
К какому типу относится данная реакция? |
Вывод:
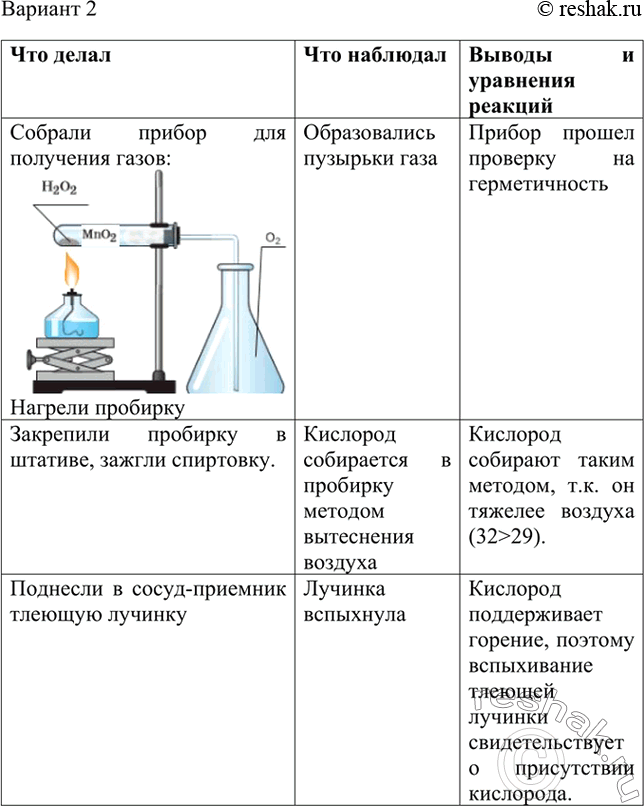
Практическая работа №5.
Решение экспериментальных задач по теме «Металлы»
Цель: изучение свойств металлов (на примере алюминия) и изучение его свойств.
Ход выполнения работы:
- Посмотрите виртуальный эксперимент
Опыт 1 (1:05)
Опыт 2 (1:10)
Опыт 3 (1:25)
Опыт 4 (1:06)
- Опишите ход эксперимента в таблице по схеме:
А → В → С → В
↓
С
- Составьте уравнения реакций;
- Ответьте на вопросы;
- Сделайте общий вывод по окончании практической работы;
- Сделайте фото работы и отправьте его на адрес электронной почты учителю.
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
Опишите реакцию по схеме А → В |
|||
|
|
|
|
В каком случае металлы взаимодействуют с кислотами? |
|
Опишите реакцию по схеме В → С |
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Каковы условия получения нерастворимого основания? |
|
Опишите реакцию по схеме С → В |
|||
|
|
|
|
Как называются реакции взаимодействия щелочи с кислотой? Относится ли данная реакция к таковым и почему? |
|
Опишите реакцию по схеме А → С |
|||
|
|
|
Рассмотрите с точки зрения окислительно-восстановительной реакции |
При каких условиях данный металл взаимодействует с водой? |
Вывод:
Практическая работа №6.
Минеральные удобрения
Цель: ознакомление с минеральными удобрениями как источником питания растительных организмов; распознавание минеральных удобрений с помощью качественных реакций на ионы.
Ход выполнения работы:
1) Посмотрите виртуальный эксперимент
опыт (5:09)
2) Опишите ход эксперимента в таблице;
3) Составьте уравнения реакций;
4) Сделайте общий вывод по окончании практической работы;
5) Сделайте фото работы и отправьте его на адрес электронной почты учителю.
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
Определение первого неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
|
|
|
|
|
|
Определение второго неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
|
Определение третьего неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
|
|
|
|
|
|
Определение четвертого неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
Вывод:
Список использованных источников
Литература:
- Кузнецова, Н.
 Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с.
Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с. - Основы химического эксперимента и занимательные опыты по химии: учебное пособие для вузов и школ / Ю.В. Бахтиярова,Р.Р. Миннуллин, В.И. Галкин. – Казань: Изд-во Казан.ун-та, 2014. – 144 с.
- Полупаненко, Е.Г.Школьный химический эксперимент: учебное пособие. — Луганск: Книта, 2018. – 176 с.
Интернет-источники:
- Амфотерные свойства гидроксида алюминия — Режим доступа: URL: https://www.youtube.com/watch?v=64P2B4loGsM (дата обращения 12.04.2020).
- Взаимодействие алюминия с соляной кислотой — Режим доступа: URL: https://www.youtube.com/watch?v=XN9U4Q8993Q (дата обращения 12.04.2020).
- Взаимодействие алюминия со щёлочью и водой — Режим доступа: URL: https://www.youtube.com/watch?v=5RvUC-3uY6c (дата обращения 12.04.2020).
- Взаимодействие аммиака с хлороводородом — Режим доступа: URL: https://www.
 youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020).
youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020). - Влияние температуры на скорость реакции — Режим доступа: URL: https://www.youtube.com/watch?v=z8ig_koe9q8 (дата обращения 29.09.2020).
- Горение аммиака в кислороде — Режим доступа: URL: https://www.youtube.com/watch?v=lMIpFie0UTY (дата обращения 26.03.2020).
- Горение магния в углекислом газе – Режим доступа: URL: https://www.youtube.com/watch?v=3zL6ZTs922M (дата обращения 22.04.2020).
- Зависимость скорости реакции от концентрации реагентов — Режим доступа: URL: https://www.youtube.com/watch?v=cKLD1ejTJg4 (дата обращения 29.09.2020).
- Зависимость скорости химической реакции от катализаторов — Режим доступа: URL: https://www.youtube.com/watch?v=f8hsZMo9x3Q (дата обращения 29.09.2020).
- Зависимость скорости химической реакции от природы реагирующих веществ — Режим доступа: URL: https://www.youtube.com/watch?v=Gah0VEO7Ps0 (дата обращения 29.09.2020).

- Изучение взаимодействия оксида углерода(IV) со щелочью — Режим доступа: URL: https://www.youtube.com/watch?v=Y4mQ0R1LGUg (дата обращения 22.04.2020).
- Исследование возможности реакции оксида углерода(IV) с хлоридом кальция — Режим доступа: URL: https://www.youtube.com/watch?v=j_cSr2-SeLU (дата обращения 22.04.2020).
- Качественная реакция на сульфат-ионы — Режим доступа: URL: https://www.youtube.com/watch?v=4yFyNl6Wb8A (дата обращения 26.09.2020).
- Отношение оксида углерода(IV) к горению — Режим доступа: URL: https://www.youtube.com/watch?v=w6vNxqxtPsY (дата обращения 22.04.2020).
- Получение аммиака — Режим доступа: URL: https://www.youtube.com/watch?v=zbwg1XwvdVw (дата обращения 26.03.2020).
- Получение гидроксида алюминия — Режим доступа: URL: https://www.youtube.com/watch?v=95vUHth8NHo (дата обращения 12.04.2020).
- Получение и собирание оксида углерода (IV) — Режим доступа: URL: https://www.
 youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020).
youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020). - Распознавание минеральных удобрений — Режим доступа: URL: https://www.youtube.com/watch?v=liHlzMqPOFA (дата обращения 06.05.2020).
- Растворение аммиака в воде — Режим доступа: URL: https://www.youtube.com/watch?v=Wh37wEk5wB8 (дата обращения 26.03.2020).
- Реакция нейтрализации — Режим доступа: URL: https://www.youtube.com/watch?v=IJIzzhYmTSU (дата обращения 26.09.2020).
Приложения:
- file0.docx.. 29,5 КБ
Коннор Браун обосновался на первой линии «Кэпиталз» с Алексом Овечкиным и Евгением Кузнецовым
АРЛИНГТОН, Вирджиния. «Кэпиталз» еще предстоит увидеть свою первую линию полностью нетронутой во время игры, но Алекс Овечкин, Евгений Кузнецов и Коннор Браун были лучшими первая группа на льду на протяжении большей части сборов.
Две трети этого трио вместе проводят доминирующий сезон в Вашингтоне. Кузнецов провел год в карьере, играя в центре фланга Овечкина, забив 24 гола и отдав 54 передачи в 79 матчах.игры. Овечкин, невосприимчивый к возрастной кривой, провел свой девятый сезон в карьере, забив 50 голов, а Кузнецов кормил его больше, чем кто-либо другой в составе.
Кузнецов провел год в карьере, играя в центре фланга Овечкина, забив 24 гола и отдав 54 передачи в 79 матчах.игры. Овечкин, невосприимчивый к возрастной кривой, провел свой девятый сезон в карьере, забив 50 голов, а Кузнецов кормил его больше, чем кто-либо другой в составе.
Поскольку вингер Том Уилсон пропустит по крайней мере первые два месяца сезона, «Кэпиталз» обращаются к недавно приобретенному Брауну, чтобы заполнить свою верхнюю строчку. 28-летний Браун оказался с ними в обмене, в результате которого «Оттава Сенаторз» получила выбор во втором раунде 2024 года. Семилетний ветеран «Сенаторов» и «Торонто Мэйпл Лифс» забил 10 голов при 29помогает в 2021-22.
Браун все еще привыкает к Овечкину и Кузнецову, привыкая к их тенденциям. Но с каждой тренировкой он чувствовал себя более уверенно и комфортно, пытаясь играть.
«Во многом это просто маршруты, — сказал Браун. «Многие ребята бегают по одинаковым маршрутам и в О-зоне, и через нейтральную зону, и через центр. Вроде как убедиться, что вы не бегаете по тем же маршрутам, что и другие парни. Так что это просто химия того, где парни будут. После трех тренировок или около того я чувствую себя все лучше и лучше, поэтому я очень рад присоединиться к ним и развить то, над чем мы работаем».
Вроде как убедиться, что вы не бегаете по тем же маршрутам, что и другие парни. Так что это просто химия того, где парни будут. После трех тренировок или около того я чувствую себя все лучше и лучше, поэтому я очень рад присоединиться к ним и развить то, над чем мы работаем».
Конечно, это не обычная линия. План атакующей игры «Кэпиталз» для их верхней линии часто вращается вокруг того, как другие команды пытаются защитить Овечкина. Кузнецов дошел до того, что сказал, что у него, вероятно, не было достаточно времени, пока была открыта раздевалка, чтобы разобраться во всех различных способах изменения его игры с Овечкиным на льду.
Но при таком большом внимании к Овечкину у Кузнецова и Брауна появится возможность найти проходы для стрельбы. Главный тренер Питер Лавиолетт был особенно впечатлен Брауном, хотя он и не видел их троих вместе вне тренировочных ситуаций.
«Они кажутся хорошими», — сказал Лавиолетт о первой линии в тренировочном лагере в понедельник. «Я пока не могу говорить с линией. Мы еще посмотрим, но я знаю Ови, я знаю Кузи, и теперь у меня есть шанс поработать с Коннором Брауном. Он действительно впечатляет своей трудовой этикой, упорством на льду и умением владеть шайбой. У него действительно сильный лагерь».
«Я пока не могу говорить с линией. Мы еще посмотрим, но я знаю Ови, я знаю Кузи, и теперь у меня есть шанс поработать с Коннором Брауном. Он действительно впечатляет своей трудовой этикой, упорством на льду и умением владеть шайбой. У него действительно сильный лагерь».
У «Кэпиталз» осталось две предсезонных игры в расписании перед открытием сезона 12 октября против «Бостон Брюинз», так что у них будет шанс по-настоящему взглянуть на Овечкина, Кузнецова и Брауна на одной линии. Браун считает, что у этого трио есть шанс стать лучшей линией, частью которой он когда-либо был.
«Мне посчастливилось играть с некоторыми хорошими игроками, но это два парня мирового уровня, поэтому, чтобы быть на их линии, я, очевидно, сделаю все, что в моих силах, чтобы помочь», — сказал Браун.
Кузнецов лидирует в разгроме «Кэпиталз» «Дэвилз»
By
Чтение за 5 минут
Кузнецов возглавляет «Кэпиталз» в разгроме «Дэвилз» перерыв в эти выходные, это Вашингтон Кэпиталз.
«Вашингтон» продолжил свой стремительный темп, одержав победу со счетом 5:2 над «Нью-Джерси Девилз» в четверг вечером в Prudential Center.
Лидирующий в лиге «Кэпиталз» (33-10-6) забил пару голов от Евгения Кузнецова, по голу и результативной передаче от Алекса Овечкина и Андре Бураковского и 27 сейвов от Брейдена Холтби.
«Вашингтон» набрал как минимум одно очко в 15 из последних 16 игр (13-1-2) и с 5 декабря показывает потрясающий результат 20-3-3. «Кэпиталз» также 9-0-1 в последних 10 играх. игры против Нью-Джерси и 6-0-2 в последних восьми играх против соперников из столичного дивизиона.
«Наша команда играет лучше, когда мы в ударе, и мы продолжаем приходить на каток, работать и играть», — сказал Холтби, который вместе с Овечкиным отправится в Лос-Анджелес, чтобы принять участие в Матче всех звезд. «Мы ожидаем, что будем хорошо играть каждую ночь; и я думаю, именно поэтому мы добились успеха».
В то время как «Кэпиталз» лидируют в своей игре, «Девилз» (20-21-9) нет. Нью-Джерси, который носил ретро-красно-зеленую форму для Retro Night, проиграл второй раз подряд и упал в третий раз из четырех перед перерывом.
Нью-Джерси, который носил ретро-красно-зеленую форму для Retro Night, проиграл второй раз подряд и упал в третий раз из четырех перед перерывом.
«Мы не там, где хотим быть», — сказал тренер «Девилз» Джон Хайнс. «Конференция напряженная, и мы должны играть лучше в хоккей».
Несмотря на то, что в четверг они провели энергичную игру, «Дьяволы» сейчас не выигрывают в своих последних шести домашних соревнованиях (0-5-1) и всего 1-7-1 в последних девяти матчах Prudential Center, датируемых 27 декабря.
Дорогостоящие потери и сомнительная игра вратаря «Дэвилз» Кита Кинкейда погубили «Нью-Джерси» в четверг, когда оппортунистические «Кэпиталз» вырвались вперед со счетом 2:0 в первом периоде благодаря голам Овечкина и Бураковского и перевесу 4:2 после два.
Похожие репортажи
Оба гола в первом периоде были забиты защитниками «Дьяволов» на своей половине площадки. Кайл Куинси отдал шайбу Овечкину при счете в начале игры на счете 6:14, а передача Джона Меррилла перед своими воротами подготовила почву для гола Бураковского на счете 18:28.
Овечкин лидирует в команде, забив 23 гола в сезоне и набрав 22 очка (9-13-22) в последних 18 играх. Бураковский забил пять голов в последних семи играх, из них 10 в сезоне.
К началу второго периода «Дьяволы» дали оживление. Они отыграли в пределах цели на 3:19, когда новичок Стефан Ноесен забил гол в своем дебютном матче за «Девилз», через день после того, как «Анахайм Дакс» потребовали от него отказа. Несколько минут спустя. Ноесен сделал великолепную передачу через лед в спешке с товарищем по команде Павлом Захой, которого ограбил Холтби.
«Я думаю, что у него было несколько хороших игр, и у него была хорошая химия с Павлом и (Джейкобом) Йозефсоном», — сказал Хайнс о Ноэсене, который забил три гола в этом сезоне. «Когда у него на клюшке шайба, случаются хорошие вещи».
Однако через несколько мгновений после того, как Холтби забил Заку камнями на 7:54, «Кэпиталз» забили два быстрых гола и обеспечили преимущество 4:1. Первым забил Ларс Эллер, который остался один на дуге, чтобы скрыть отскок на 8:29.
«Это был важный гол в важный момент игры», — сказал Эллер, забивший четыре гола в последних шести играх. «Мы знали, что следующий гол будет огромным. Либо 2-2, либо 3-1. Оттуда мы сделали то, что должны были».
Затем Кузнецову засчитали гол в большинстве после того, как шайба соскользнула с его клюшки и каким-то образом между накладками Кинкейда на 10:19.
«Я упустил шайбу, и мне просто повезло», — сказал Кузнецов, который после чрезвычайно медленного старта в этом сезоне забил девять голов, в том числе четыре в последних пяти играх.
Пропустив этот гол, Кинкейд был удален из игры, пропустив четыре гола при 17 ударах, и заменен в воротах Кори Шнайдером.
Адам Энрике отыграл за «Дьяволов» — его 12-й гол в сезоне — с отклонением в большинстве за 1:44 до второго перерыва, и счет стал 4-2. Вторая игра Кузнецова в пустые ворота с 1:53 до игры в основное время замкнула счет.
Игра в четверг стала седьмой раз за последние девять игр, когда «Кэпиталз» забили пять и более голов.


 Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008.
Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008. символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций;
символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций; элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ;
элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ;
 Инструктаж по ТБ. Первая помощь при ожогах, отравлениях, порезах.
Инструктаж по ТБ. Первая помощь при ожогах, отравлениях, порезах.
 Чистые вещества и смеси. Методы разделения смесей.
Чистые вещества и смеси. Методы разделения смесей.











/001.jpg)

 Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с.
Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с. youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020).
youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020).
 youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020).
youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020).