Практическая работа 2. Задача 1 Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
Практическая работа 2. Задача 1 Химия 9 класс Рудзитис, Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помогите решить
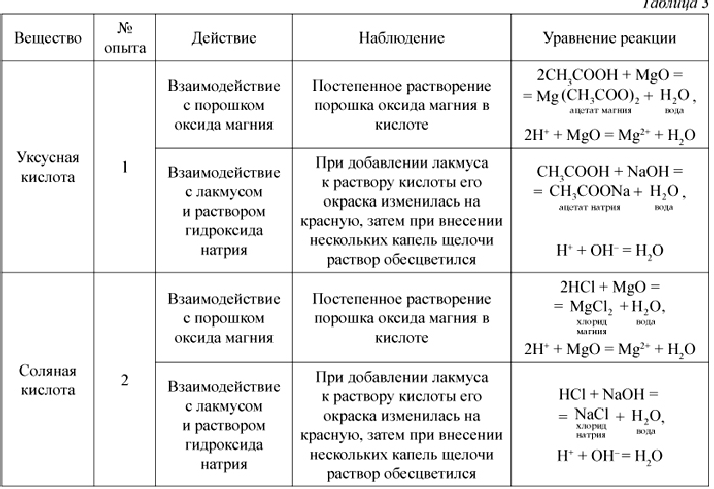
Налейте в пробирку 1—2 мл концентрированной серной кислоты и опустите в нее кусочек цинка.
ответы
На данные растворы можно было бы подействовать любой более сильной кислотой, например: НСl, HNО3, НВr, Н3РО4
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
(Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Конспект урока практическая работа №1 в 9 классе
Конспект урока
по химии
9 класс
Учитель: Покляцкая Е.Г.
Тема: Практическая работа №1«Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Цели урока: проводить реакции между веществами в растворе, получать новые вещества из имеющихся реактивов; записывать уравнения реакций в молекулярном, ионном виде; проводить наблюдения; делать выводы; способствовать совершенствованию умения осуществлять само- и взаимоконтроль за результатами проведенного химического эксперимента, умения своевременно оформлять отчет о проделанной работе, рационально распределяя свое время; соблюдать правила по технике безопасности;
Планируемые результаты урока:
Предметные: изучить свойства кислот, оснований и солей, как электролитов признаки, закрепить умение составлять уравнения химических реакций в молекулярном и ионном видах.
Метапредметные: уметь наблюдать, анализировать, делать выводы, формировать свои мысли, применять теоретические знания на практике.
Личностные: работать в группах, самостоятельно и безопасно выполнять основные навыки работы с химическим оборудованием и реактивами.
Тип урока: практическая работа
Оборудование: инструкционные карты; штативы с пробирками, химические стаканы; растворы: соляной кислоты, карбоната натрия, хлорида бария, хлорида калия, сульфат меди (II).
Ход работы:
1.Организационный момент
2.Подготовка к проведению практической работы.
Повторение ТБ:
1.Приступая к занятиям, учащийся должен четко понимать ход и порядок выполнения работы и следовать технике безопасности на уроке.
2.Во время урока учащиеся должны следовать указаниям преподаватели и инструкциям техники безопасности, быть очень внимательными. Приступать к эксперименту можно только с разрешения учителя.
Приступать к эксперименту можно только с разрешения учителя.
3.Категорически запрещается пробовать на вкус вещества в кабинете химии.
4.Учащимся запрещено проводить любые опыты, которые не предусмотрены текущим планом урока.
5.О рассыпанных веществах или разлитых реактивах ученик должен незамедлительно сообщить учителю. Учащимся запрещено проводить самостоятельную уборку веществ без разрешения учителя.
6.Обо всех неполадках в работе оборудования или других сложностях ученики должны сообщить немедленно учителю и прекратить работу. Школьникам запрещено самостоятельно устранять неполадки.
7.Нельзя выливать в канализацию органические жидкости и растворы.
8.После занятий на уроке химии школьники должны привести в порядок рабочее место, сдать оборудование и реактивы и грязную посуду сдать лаборанту или учителю.
9.Необходимо тщательно вымыть руки с мылом.
Учитель: Выполнять практическую работу вы будете, работая в группах. Каждая группа получает инструкционную карту, согласно этой карте необходимо выполнять практическую работу.
3.Проведение практической работы.
(Использование инструкционной карты) Приложение№1
4.Оформление практической работы.
(После проведения работы, сделайте вывод, запишите все результаты в тетрадь, уберите рабочее место.)
5.Рефлексия.
Какие трудности вы испытывали при выполнении практической работы?
Какие реакции вам понравилось проводить больше всего?
Как работал класс?
Кто из учащихся работал особенно хорошо?
6.Д/З повторить п.9-10, выполнить задание№5(вариант1) на стр.42
Приложение№1
Инструкционная карта
Практическая работа № 1
Тема: «Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»
Цель: (самостоятельно)
Оборудование и реактивы: штатив с пробирками, химические стаканы.
растворы: соляной кислоты, карбоната натрия, хлорида бария, хлорида калия, сульфат меди (II).
Повторение ТБ: 1) аккуратно работать с реактивами и приборами; 2) не смешивать реактивы без согласования с заданием;3) обо всех неполадках в работе оборудования или других сложностях должны сообщить немедленно учителю и прекратить работу, запрещено самостоятельно устранять неполадки.
Ход работы
С правилами ТБ ознакомлен (а).
Осуществите эксперимент:
Последовательно осуществите 3 реакции для карбоната натрия:
1) к 1 мл карбоната натрия добавьте 1 мл хлорида бария;
2) к 1 мл карбоната натрия добавьте 1 мл соляной кислоты;
3) к 1 мл карбоната натрия добавьте 1 мл хлорида калия.
Опишите наблюдения и ход работы оформив таблицу.
Составьте уравнения реакций, идущих до конца, в молекулярном, ионном и сокращенном ионном виде.
№ опыта | Что делали | Что наблюдали | Уравнение реакции |
Вывод (по цели).
Рабочая тетрадь по химии 9 класс
Химия 9 класс
Рабочая тетрадь
Габриелян Сладков
Для понимания химия требует высокой концентрации и внимания. Не все девятиклассники обладают этими качествами. Решебник который идет в комплекте с учебником. «Химия Рабочая тетрадь 9 класс Габриелян, Сладков Дрофа» поможет Вам справиться с более сложными заданиями по химии для 9 класса .
Что можно сказать о решателе
Эта книга отлично подходит для обучения детей. химия . Среди его достоинств можно выделить следующие:
- Интересный дизайн абзаца.
- Задания, как правило, простые, если вы хорошо понимаете пройденный материал.
- Все объясняется просто и понятно.
- Эксперименты, которые вы будете ставить вместе с учителем или самостоятельно.
Подводя итоги, можно сказать, что данный учебник имеет огромное количество достоинств и идеально подходит для изучения химия на базовом уровне.
Что вам может помочь
Про Решебник было сказано . Не стоит воспринимать его как способ просто списать задачи и получить пятерку. Он создан специально для того, чтобы помочь вам разобраться в любой сложной теме.
Решебник , конечно, не сможет дать вам знаний, но сможет помочь в понимании решения любой проблемы со 100% вероятностью.
По окончании девятого класса 9Подростки 0012 ждут госаттестации, которая ни у кого особого энтузиазма не вызывает, тем более, что требуется сдать не только необходимые предметы, но и
Что в него входит.
Пособие имеет нумерацию страниц, что очень удобно для быстрого поиска нужного задания. Тщательно детализированные упражнения ГДЗ по химии 9 класс Габриелян помогают учащимся лучше усвоить материал В конце пособия приведены дополнительные задания для подготовки к ГИА
Тщательно детализированные упражнения ГДЗ по химии 9 класс Габриелян помогают учащимся лучше усвоить материал В конце пособия приведены дополнительные задания для подготовки к ГИА
Нужен ли вам решатель?
Сложность некоторых заданий требует безоговорочной помощи, которую подросткам зачастую просто неоткуда взять Можно, конечно, надеяться, что она все равно пройдет и тем самым подвергнуть себя риску получить плохую отметку, а можно воспользоваться туториалом 9.0011 «Химия. Рабочая тетрадь 9 класс» Габриелян , с помощью которой можно разобраться во всех тонкостях решения нужного упражнения.
Химия Рабочая тетрадь 9 класс Гара Ахметов «Вентана-Граф»
Школьная программа по химия с каждым годом становится все сложнее. У многих девятиклассников не очень получается с этим. Пробелы в понимании материала грозят неудовлетворительными результатами в учебе и проблемами в будущем. Чтобы этого избежать, специалисты рекомендуют использовать «ГДЗ по химии 9 класс Рабочая тетрадь Гара, Ахметова Вентана-граф» .
Helpful Assistant
Подробно описаны правильные и предельно понятные онлайн-ответы. Они помогут:
- выполнить заданную дома работу без ошибок;
- хорошо подготовиться к самостоятельной работе в классе;
- понять и разобрать особо сложную тему.
наслаждайтесь решателем просто и легко. Его структура аналогична структуре учебного пособия, и номера упражнений точно такие же. Систематическое использование ГДЗ только положительно скажется на обучении.
Что в тетради
Специальные пособия, входящие в учебные комплекты, помогут Вам запомнить и отработать пройденный материал в полном объеме. Рабочая тетрадь по химии для 9 класса авторов Гара, Ахметова одна из тех. Работая в ней, студент будет закреплять не только теоретические знания, но и практические навыки и умения. Издание соответствует всем требованиям ФГОС и рекомендовано для образовательных учреждений.
Составьте генетический ряд лития и проведите трансформации.
 Генетический ряд металлов и их соединений. Практические отчеты
Генетический ряд металлов и их соединений. Практические отчеты
Повторение. Генетическая связь классов не является органическими соединениями
Введение
Тема этого урока «Повторение. Генетическая связь классов неорганических соединений». Вы повторите, как делятся все неорганические вещества, сделаете вывод, как из одного класса можно получить другой класс неорганических соединений. На основании полученной информации вы узнаете, какова генетическая связь таких классы, два основных способа таких соединений.
Тема: Введение
Урок: Повторение. Генетическая связь классов неорганических соединений
Химия — наука о веществах, их свойствах и превращениях друг в друга.
Рис. 1. Генетическая связь классов неорганических соединений
Все неорганические вещества можно разделить на:
Простые вещества
Сложные вещества.
Простые вещества подразделяются на:
Металлы
Неметаллы
Соединения можно разделить на:
Основы
Кислоты
Соль. См. рис.1.
См. рис.1.
Это бинарные соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Рис.2.
Например, оксид кальция: Ca +2 O -2, оксид фосфора (V) P 2 O 5., оксид азота (IV) -« «Лисиный хвост»
Рис. 2. Оксиды
Подразделяются на:
Основные
Кислые
Основные оксиды
Оксиды кислот соответствуют кислотам .
соль состоит из катионов металлов И анионов кислотных остатков .
Рис. 3. Пути генетических связей между веществами
Таким образом: из одного класса неорганических соединений может быть получен другой класс.
Следовательно, все классов неорганических веществ взаимосвязаны .
Класс связи неорганических соединений часто называют генетическими. Рис.3.
Бытие в переводе с греческого означает «происхождение». Те. генетическая связь показывает связь между превращением веществ и их происхождением из одного вещества.
Те. генетическая связь показывает связь между превращением веществ и их происхождением из одного вещества.
Существует два основных способа генетических взаимоотношений между веществами. Одна из них начинается с металла, другая с неметалла.
Генетическая серия металлов
показывает:Металл → Основной оксид → Соль → Основание → Новая соль.
Генетический ряд неметалла отражает следующие превращения:
Неметалл → Кислотный оксид → Кислота → Соль.
Для любого генетического ряда можно написать уравнения реакций, которые показывают превращение одного вещества в другое .
Для начала необходимо определить, к какому классу неорганических соединений относится каждое вещество генетического ряда.
подумать как получить вещество, стоящее после него, из вещества, стоящего перед стрелкой.
Пример №1. Генетический ряд металла.
Ряд начинается с простого вещества металлической меди. Чтобы совершить первый переход, нужно сжечь медь в атмосфере кислорода.
Чтобы совершить первый переход, нужно сжечь медь в атмосфере кислорода.
2Cu +O 2 →2CuO
Второй переход: нужно получить соль CuCl 2 . Образуется соляной кислотой HCl, потому что соли соляной кислоты называются хлоридами.
CuO +2 HCl → CuCl 2 + H 2 O
Третий шаг: чтобы получить нерастворимое основание, нужно к растворимой соли добавить щелочь.
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
Для превращения гидроксида меди (II) в сульфат меди (II) к нему добавляют серную кислоту h3SO4.
Cu(OH) 2 ↓ + H 2 SO 4 → CuSO 4 + 2H 2 O
Пример №2. Генетический ряд неметалла.
Ряд начинается с простого вещества, неметаллического углерода. Чтобы совершить первый переход, нужно сжечь углерод в атмосфере кислорода.
C + O 2 → CO 2
При добавлении воды к кислому оксиду получается кислота, которую называют угольной кислотой.
CO 2 + H 2 O → H 2 CO 3
Для получения соли угольной кислоты — карбоната кальция необходимо добавить к кислоте соединение кальция, например гидроксид кальция Ca(OH) 2.
H 2 CO 3 + Ca(OH) 2 → CaCO 3 + 2H 2 O
В состав любого генетического ряда входят вещества различных классов неорганических соединений.
Но эти вещества обязательно включают один и тот же элемент. Зная классы химических свойств соединений, можно подобрать уравнения реакций, с помощью которых можно осуществить эти превращения. Эти превращения используются и в производстве, для выбора наиболее рациональных способов получения тех или иных веществ.
Вы повторили, как делятся все неорганические вещества, сделали вывод, как из одного класса можно получить другой класс неорганических соединений. На основе полученной информации мы узнали, каково генетическое родство таких классов, два основных способа такого родства .
1. Рудзитис Г.Э. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г.Э. Рудзитис, Ф.Г. Фельдман М.: Просвещение. 2011 176 с.: ил.
2. Попель П.П. Химия: 8 класс: учебник для общеобразовательных учреждений / П. П. Попель, Л.С. Кривля. -К.: ИЦ «Академия», 2008. — 240 с.: ил.
П. Попель, Л.С. Кривля. -К.: ИЦ «Академия», 2008. — 240 с.: ил.
3. Габриелян О.С. Химия. Учебник для 9 класса. Издательство: Дрофа.: 2001. 224с.
1. № 10-а, 10з (стр. 112) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Э. Рудзитис, Ф.Г. Фельдман М.: Просвещение. 2011 176с.: ил.
2. Как получить сульфат кальция из оксида кальция двумя способами?
3. Составьте генетический ряд получения сульфата бария из серы. Напишите уравнения реакций.
Генетическая связь между веществами – это такая связь, которая основана на их взаимных превращениях, отражает единство происхождения веществ, иначе говоря, генезис.
При знании классов простых веществ можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов выявляет взаимосвязь веществ разных классов, основу которой составляет один и тот же металл.
Генетический ряд металлов бывает двух типов.
1. Генетический ряд металлов, которым соответствует щелочь в виде гидроксида. Такой ряд можно представить аналогичной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем, к примеру, генетический ряд кальция:
Ca → CaO → Ca(OH) 2 → Ca 3 (ПО 4) 2.
2. Генетический ряд металлов, соответствующих нерастворимым основаниям. Генетических связей в этом ряду больше, потому что он более полно отражает представление о прямых и обратных превращениях (взаимных). Такой ряд можно представить следующей цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем, к примеру, генетический ряд меди:
Cu → CuO → CuCl 2 → Cu(OH) 2 → CuO → Cu.
Генетический ряд неметаллов выявляет родство веществ разных классов, основу которых составляет один и тот же неметалл.
Выделим еще две разновидности.
1. Генетический ряд неметаллов, которому растворимая кислота соответствует как гидроксид, можно изобразить в виде следующей линии превращений:
Генетический ряд неметаллов, которому растворимая кислота соответствует как гидроксид, можно изобразить в виде следующей линии превращений:
неметалл → оксид кислоты → кислота → соль.
Возьмем, к примеру, генетический ряд фосфора:
P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4) 2.
2. Генетический ряд неметаллов, к которым относится нерастворимая кислота соответствует, может быть представлена следующей цепочкой преобразований:
неметалл → оксид кислоты → соль → кислота → оксид кислоты → неметалл.
Поскольку из рассмотренных кислот нерастворима только кремниевая кислота, рассмотрим на примере генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Си.
Итак, подытожим и выделим самую основную информацию.
Целостность и разнообразие химических веществ наиболее выражены в генетической связи веществ, которая выявляется в генетическом ряду. Рассмотрим наиболее важные признаки генетического ряда:
Генетический ряд – это группа органических соединений, имеющих равное количество атомов углерода в молекуле, отличающихся функциональными группами.
Генетическая связь — более общее понятие, в отличие от генетического ряда, которое хотя и является достаточно ярким, но в то же время частным проявлением этой связи, которое может иметь место при любых билатеральных превращениях веществ.
блог.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
ЭТИ РАБОТЫ
Многое уже позади и теперь ты выпускник, если, конечно, вовремя напишешь дипломную работу. Но жизнь такая штука, что только сейчас тебе становится ясно, что, перестав быть студентом, ты потеряешь все студенческие радости, многие из которых ты не пробовал, все откладывая и откладывая на потом. А теперь, вместо того, чтобы наверстать упущенное, вы со своей диссертацией возитесь? Есть отличный выход: скачайте нужную дипломную работу с нашего сайта – и у вас моментально появится куча свободного времени!
Дипломные работы успешно защищены в ведущих ВУЗах Республики Казахстан.
Стоимость работы от 20 000 тенге
КУРСОВЫЕ РАБОТЫ
Курсовой проект является первой серьезной практической работой. Именно с написания курсовой работы начинается подготовка к разработке дипломных проектов. Если студент научится правильно излагать содержание темы в курсовом проекте и грамотно его оформлять, то в дальнейшем у него не будет проблем ни с написанием докладов, ни с составлением дипломных работ, ни с выполнением других практических заданий. В целях оказания помощи студентам в написании данного вида студенческой работы и уточнения вопросов, возникающих в ходе ее подготовки, собственно, и создан данный информационный раздел.
Именно с написания курсовой работы начинается подготовка к разработке дипломных проектов. Если студент научится правильно излагать содержание темы в курсовом проекте и грамотно его оформлять, то в дальнейшем у него не будет проблем ни с написанием докладов, ни с составлением дипломных работ, ни с выполнением других практических заданий. В целях оказания помощи студентам в написании данного вида студенческой работы и уточнения вопросов, возникающих в ходе ее подготовки, собственно, и создан данный информационный раздел.
Стоимость работы от 2 500 тенге
МАГИСТЕРСКИЕ ДИССЕРТАЦИИ
В настоящее время в высших учебных заведениях Казахстана и стран СНГ очень распространена степень о высшем образовании. профессиональное образование, которое следует после бакалавриата – магистра. В магистратуре студенты учатся с целью получения степени магистра, которая признается в большинстве стран мира больше, чем степень бакалавра, а также признается зарубежными работодателями. Результатом обучения в магистратуре является защита кандидатской диссертации.
Предоставим Вам актуальный аналитический и текстовый материал, в стоимость включены 2 научные статьи и реферат.
Стоимость работы от 35 000 тенге
ОТЧЕТЫ ПО ПРАКТИКЕ
После прохождения любого вида студенческой практики (учебной, производственной, преддипломной) требуется отчет. Этот документ будет доказательством практической работы студента и основанием для формирования оценок за практику. Обычно для составления отчета по стажировке необходимо собрать и проанализировать информацию о предприятии, рассмотреть структуру и график работы организации, в которой проходит стажировка, составить календарный план и описать свою практическую деятельность.
Поможем написать отчет по стажировке с учетом специфики деятельности конкретного предприятия.
Каждый такой ряд состоит из металла, его основного оксида, основания и любой соли того же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
2Са + О 2 = 2СаО; 2Mg + O 2 = 2MgO;
Переход от основных оксидов к основаниям в первых двух рядах осуществляется по известной вам реакции гидратации, например:
CaO + H 2 O = Ca(OH) 2.
Что касается двух последних рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а затем в основания. Поэтому, например, для осуществления перехода из оксида MgO в гидроксид Mg(OH) 2 используют последовательные реакции:
MgO + H 2 SO 4 = MgSO 4 + H 2 O; MgSO 4 + 2NaOH = Mg(OH) 2 ↓ + Na 2 SO 4.
Переходы из оснований в соли осуществляются по уже известным вам реакциям. Так, растворимые основания (щелочи), находящиеся в первых двух рядах, под действием кислот, кислых оксидов или солей превращаются в соли. Нерастворимые основания из двух последних рядов под действием кислот образуют соли.
Генетический ряд неметаллов и их соединений .
Каждый такой ряд состоит из неметалла, кислого оксида, соответствующей кислоты и соли, содержащей анионы этой кислоты:
Для перехода от неметаллов к кислым оксидам во всех этих рядах реакции сочетания с кислородом применяют, например:
4P + 5O 2 = 2 P 2 O 5 ; Si + O 2 = SiO 2 ;
Переход кислых оксидов в кислоты первых трех рядов осуществляется по известной вам реакции гидратации, например:
P 2 O 5 + 3H 2 O = 2 H 3 PO 4.
Однако вы знаете, что оксид SiO 2 , содержащийся в последнем ряду, с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O; K 2 SiO 3 + 2HСl = 2KCl + H 2 SiO 3 ↓.
Переходы кислот в соли могут осуществляться по известным вам реакциям с основными оксидами, основаниями или с солями.
Следует помнить:
Вещества одного и того же генетического ряда не реагируют друг с другом.
Вещества различных типов генетических рядов реагируют друг с другом. Продуктами таких реакций всегда являются соли (рис. 5):
Рис. 5. Схема родства веществ разных генетических рядов.
Эта диаграмма изображает взаимосвязь между различными классами неорганических соединений и объясняет разнообразие химических реакций между ними.
Тема задания:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
2. P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4;
3. Ca → CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CaO;
4. S → SO 2 → H 2 SO 3 → K 2 SO 3 → H 2 SO 3 → BaSO 3;
5. Zn → ZnO → ZnCl 2 → Zn(OH) 2 → ZnSO 4 → Zn(OH) 2;
6. C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3;
7. Al → Al 2 (SO 4 ) 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 ;
8. Fe → FeCl 2 → FeSO 4 → Fe(OH) 2 → FeO → Fe 3 (PO 4) 2;
9. Si → SiO 2 → H 2 SiO 3 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2;
10. Mg → MgCl 2 → Mg(OH) 2 → MgSO 4 → MgCO 3 → MgO;
11. K → KOH → K 2 CO 3 → KCl → K 2 SO 4 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3;
13. S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3;
14. Cl 2 → HCl → AlCl 3 → KCl → HCl → H 2 CO 3 → CaCO 3 ;
15. FeO → Fe(OH) 2 → FeSO 4 → FeCl 2 → Fe(OH) 2 → FeO;
16. CO 2 → K 2 CO 3 → CaCO 3 → CO 2 → BaCO 3 → H 2 CO 3 ;
17. K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3;
K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3;
18. P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4 → H 2 SO 3 ;
19. Al 2 O 3 → AlCl 3 → Al(OH) 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3;
20. SO 3 → H 2 SO 4 → FeSO 4 → Na 2 SO 4 → NaCl → HCl;
21. KOH → KCl → K 2 SO 4 → KOH → Zn(OH) 2 → ZnO;
22. Fe(OH) 2 → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe(NO 3) 2 → Fe;
23. Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgSO 4 → Mg(OH) 2 → MgCl 2 ;
24. Al(OH) 3 → Al 2 O 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 → Al(OH) 3;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3;
26. HNO 3 → Ca(NO 3) 2 → CaCO 3 → CaCl 2 → HCl → AlCl 3 ;
27. CuСO 3 → Cu(NO 3) 2 → Cu(OH) 2 → CuO → CuSO 4 → Cu;
28. MgSO 4 → MgCl 2 → Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgCO 3;
29. K 2 S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3;
30. ZnSO 4 → Zn(OH) 2 → ZnCl 2 → HCl → AlCl 3 → Al(OH) 3;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu(OH) 2 → H 2 O → HNO 3;
Данное занятие посвящено обобщению и систематизации знаний по теме «Классы неорганических веществ».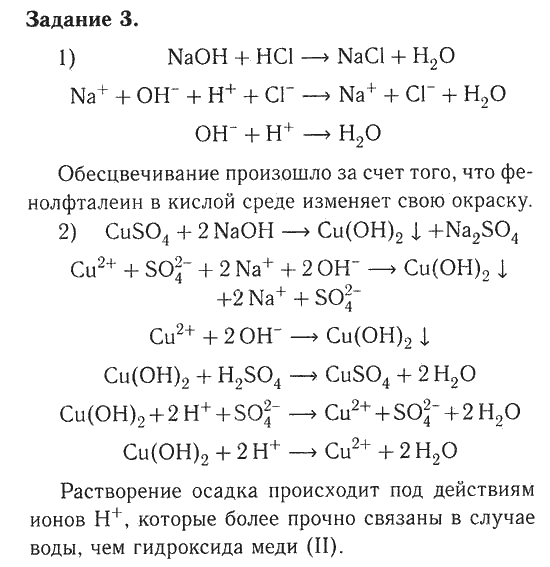 Учитель расскажет, как можно получить вещество другого класса из веществ одного класса. Полученные знания и навыки пригодятся для составления уравнений реакций цепочек превращений.
Учитель расскажет, как можно получить вещество другого класса из веществ одного класса. Полученные знания и навыки пригодятся для составления уравнений реакций цепочек превращений.
В ходе химических реакций химический элемент не исчезает; атомы переходят из одного вещества в другое. атомы химического элемента как бы переходят из простого вещества в более сложное и наоборот. Таким образом, возникают так называемые генетические ряды, начинающиеся с простого вещества — металла или неметалла — и заканчивающиеся солью.
Напомню, что в состав солей входят металлы и кислотные остатки. Итак, генетический ряд металла может выглядеть так:
Основной оксид можно получить из металла в результате реакции соединения с кислородом, основной оксид при взаимодействии с водой дает основание (только если этим основанием является щелочь), можно получить соль из основания в результате реакции обмена с кислотой, солью или оксидом кислоты.
Обратите внимание, что этот генетический ряд подходит только для металлов, гидроксиды которых являются щелочами.

