Практическая работа «Решение экспериментальных задач на распознавание и получение соединений металлов»
Практическая работа «Решение экспериментальных задач на распознавание и получение соединений металлов»
(план – конспект урока химии , 9 класс, О.С.Габриелян)
Место урока: Урок входит в состав блока практических работ, которыми завершается тема «Металлы», проводится после изучения теоретического материала о получении и свойствах металлов главных и побочных подгрупп.
Цель урока: Проверить уровень практических навыков, умение применять теоретические знания в практических ситуациях, закрепить умения осуществлять качественные реакции и оформлять результаты наблюдений.
Задачи урока:
1.Закрепить знания о получении и химических свойствах металлов и их соединений.
2.Совершенствовать навыки работы с химическим оборудованием и реактивами.
3. Совершенствовать
навыки проведения эксперимента и оформления его результатов.
Совершенствовать
навыки проведения эксперимента и оформления его результатов.
4.Совершенствовать умения работать по инструкции, а также осуществлять планирование действий при решении экспериментальных задач.
5. Развивать навыки логического мышления при решении экспериментальных задач.
6.Совершенствовать навыки соблюдения требований безопасного обращения с химическим оборудованием и реактивами.
Тип урока: урок- практикум.
Оборудование: Минилаборатория (набор химических реактивов и оборудования ) на столах учащихся.
ТСО: компьютер, проектор.
Ход урока:
1. Организационная часть. (3минуты)
( до начала урока учащимся предлагается одеть халаты)
Учитель:
Богат и интересен мир металлов. Вы познакомились со строением и свойствами
некоторых из них. Сегодня мы попадем в удивительный мир превращений металлов и
их соединений. Цель сегодняшнего урока — применить теоретические знания при
выполнении практических заданий, показать практические навыки безопасной
работы с химическим оборудованием и реактивами.
Нам предстоит выполнить 4 практических задания. Напомните себе их содержание.(На предыдущем уроке учащиеся получили задание ознакомиться со всеми практическими заданиями, были проанализированы цели и содержание каждого. Из предложенных заданий для проведения практической работы были выбраны 4).
2. Повторение правил ТБ. (5 минут)
Учитель: Прежде, чем приступить к выполнению практической работы, мы должны напомнить себе правила техники безопасности при выполнении практических работ. Содержание и порядок выполнения опытов подскажут нам, с какими опасностями мы можем столкнуться при их выполнении. ( с учащимися обсуждается вопрос безопасного обращения с кислотами и щелочами, меры оказания первой помощи при их попадании на одежду и кожу, правили обращения с нагревательными приборами).

Учитель : Напоминаю вам общие требования по выполнению заданий.
( на экран выводится следующая информация)
Общие требования при выполнении химического эксперимента
1.Изучите инструкцию по проведению опыта.
2.Проведите описанный опыт, соблюдая правила техники безопасности.
3.Объясните результаты, полученные при проведении опыта.
4.Сделайте вывод.
5.Оформите отчет.
3.Выполнение практической работы. (2 минуты)
Учитель: Приступаем к выполнению работы. Подготовим тетради для ее оформления. Записываем номер и тему практической работы (записаны на доске : Практическая работа № 2. Получение и свойства соединений металлов.).
Учитель: При выполнении заданий будут учитываться навыки выполнения практической работы,
соблюдение правил безопасного ее выполнения, а также письменный отчет по
каждому из предложенных опытов. Отчет оформляется сразу же после проведения
опыта.
Отчет оформляется сразу же после проведения
опыта.
Задание 1 (8 минут)
Осуществите следующие превращения:
Fe → FeCI2 → Fe(OH)2
Опишите происходящие с веществами изменения. Напишите уравнения соответствующих реакций. Рассмотрите первое уравнение с точки зрения окисления — восстановления, второе запишите в молекулярной и ионной формах.
Объясните изменения, происходящие с конечным продуктом последней реакции. Запишите соответствующее уравнение реакции.
Учитель: Какие знания нам могут пригодиться, чтобы справиться с данным заданием? (железо — элемент побочной подгруппы, имеет несколько степеней окисления, соединения железа окрашены, среди них есть растворимые и нерастворимые).
Приступайте к выполнению задания.
Описание опыта:
В пробирку с железными опилками
добавляется раствор соляной кислоты. Наблюдается растворение железа, изменение
окраски раствора и выделение газообразного водорода:
Наблюдается растворение железа, изменение
окраски раствора и выделение газообразного водорода:
Fe0 + 2Н+1Сl-1 = Fe+2Cl-12 + Н20↑
Fe0 — 2е = Fe+2 2 1 восстановитель
2Н+1 +2е = Н20 2 1 окислитель
При добавлении к хлориду железа щелочи выпадает белый осадок.
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓
Fe2+ + 2Сl- + 2Na+ + 2ОH- = 2Na+ + 2Сl- + Fe(OH)2↓
Fe2+ + 2ОH- = Fe(ОH)2↓
На воздухе гидроксид железа (II) превращается в гидроксид железа(III).
4Fe(OH)2 + 2Н2О + О2 = 4Fe(OH)3
Учитель: Завершаем выполнение первого задания, приступаем к заданию 2. Напомните себе его содержание.
Задание 2 ( 8 минут)
Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.
Учитель:
Что необходимо знать для выполнения этого опыта? Чем можно воспользоваться,
чтобы не допустить ошибок. (знать, какие реакции называются качественными,
могут помочь в выполнении заданий таблицы: таблица растворимости и таблица,
показывающая качественные реакции на катионы и анионы).
Описание опыта:
Для доказательства качественного состава СаС12 проводятся реакции, характерные для катиона кальция и хлорид-аниона. Для этого раствор СаС12 наливается в 2 пробирки.
В одну из них добавляется раствор карбоната натрия:
Na2CО3 + СаС12 = CaCО3↓ + 2NaCl
2Na+ + СО32- + Са2+ + 2Сl- = СаСО3↓ +2Na+ + 2Сl-
Са2+ + СО32- = CaCО3↓
Наблюдается выделение белого осадка карбоната кальция СаСО3. Данная реакция доказывает наличие катиона кальция.
В другую пробирку приливается раствор нитрата серебра.
СаС12 + 2AgNО3 = Ca(NО3)2 + 2AgCl↓
Са2+ + 2Сl- + 2Ag+ + 2NО3- = Ca2++ 2NО3- + 2AgCl↓
Сl- + Ag+ = AgCl↓
Наблюдается выделение белого творожистого осадка. Это — качественная реакция на хлорид-анион.
Учитель: Приступаем к выполнению третьего задания, прочитайте его.
Задание 3 (8 минут)
Получите
сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного
обмена запишите в молекулярной и ионной формах, а реакции замещения
рассмотрите с точки зрения окисления-восстановления.
Учитель : Что необходимо знать, чтобы осуществить эти превращения? (химические свойства веществ). В результате каких реакций получаются соли?
( при взаимодействии металла с неметаллом, оксида металла с кислотой, основания с кислотой, соли с кислотой. основания с солью , соли с металлом).
Проделайте соответствующие заданию реакции. Каждый способ получения должен проходить в одну стадию. При необходимости воспользуйтесь нагреванием. Твердые вещества берите в небольших количествах.
Описание опыта:
1 способ. В пробирку с железными опилками приливается разбавленный раствор серной кислоты. Наблюдается растворение железа, окрашивание раствора и выделение водорода.
Fe° + h3+1’S04 -» Fe+2S04 + h3°↑
Fe0 —
2Н+1 +2е = Н20 2 1 окислитель
В результате реакции образуется сульфат железа.
2
способ. В пробирку с раствором медного купороса
добавляется железо. Наблюдается изменение окраски раствора, из голубого раствор
становится светло-зеленым . В результате реакции выделяется красная медь.
Наблюдается изменение окраски раствора, из голубого раствор
становится светло-зеленым . В результате реакции выделяется красная медь.
Cu+2SO4 + Fe0 = Fe+2SO4 + Cu0
Fe0 —2е= Fe+2 восстановитель
Cu+2 +2е = Cu0 окислитель
В результате реакции образуется сульфат железа.
3 способ. В пробирку с оксидом железа добавляется серная кислота. При необходимости проводится нагревание. Происходит изменение окраски раствора.
FeО + h3SО4 = FeSО4 + h3О
В результате реакции образуется сульфат железа.
Возможен вариант получения сульфата железа(II) действием на карбонат железа(II) серной кислоты.
Учитель: Последним заданием для вас будет экспериментальная задача. Прочитайте ее.
Задание 4. ( 8 минут)
Экспериментальная задача.
В
математике действует правило — «от перемены мест слагаемых сумма не изменяется».
Справедливо ли оно для химии? Проверьте это на примере следующего опыта.
Получите гидроксид алюминия по реакции обмена . Для этого вы можете использовать реакцию, уравнение которой
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Проведите эту реакцию в двух вариантах, используя в каждом варианте одинаковые объемы исходных веществ: сначала к раствору одного из исходных веществ (реагенту) прибавляйте по каплям раствор другого реагента, затем поменяйте последовательность введения в реакцию реагентов. Наблюдайте, в каком случае выпадет осадок, а в каком — нет.
Объясните результаты и запишите уравнения проведенных реакций в молекулярной форме.
Учитель: Давайте еще раз вместе обсудим план действий для проведения эксперимента.
(1.Взять две одинаковые пробирки.
2. В первую пробирку налить раствор хлорида алюминия.
3. Во вторую пробирку налить такой же объем гидроксида натрия.
4. В первую пробирку добавить несколько капель гидроксида натрия.
5.
Во вторую пробирку добавить столько же капель хлорида алюминия.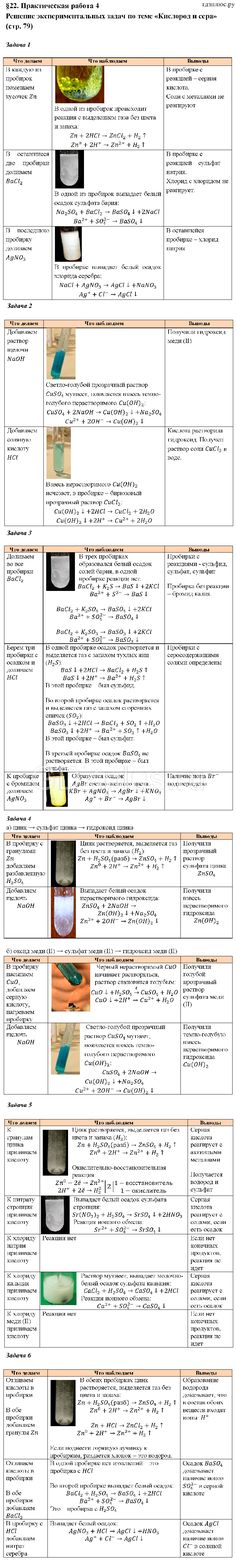
6. Наблюдать, какие изменения произойдут в пробирках.
7. Найти объяснения изменениям и оформить результаты наблюдений.)
Учитель: Приступайте к выполнению задания.
Описание опыта:
В пробирку с раствором хлорида алюминия добавляют по каплям раствор щелочи:
А1С13 + 3NaOH(недостаток) = 3NaCl + Al(OH)3↓
Наблюдают образование белого осадка гидроксида алюминия. Если же добавить еще гидроксид натрия, то образовавшийся гидроксид алюминия провзаимодействует с ним с образованием алюмината натрия и осадок растворится.
В другую пробирку с раствором щелочи добавляют раствор хлорида алюминия. В данном случае, щелочь присутствует в избытке, поэтому А1(ОН)3 вначале не образуется, идет образование алюмината натрия:
А1С13 + 4NaOH (избыток) = NaA1О2 + 3NaCl + 2Н2О
Алюминат натрия растворим, осадка не образуется.
Отсюда можно
сделать вывод, что гидроксид алюминия можно получить только первым способом.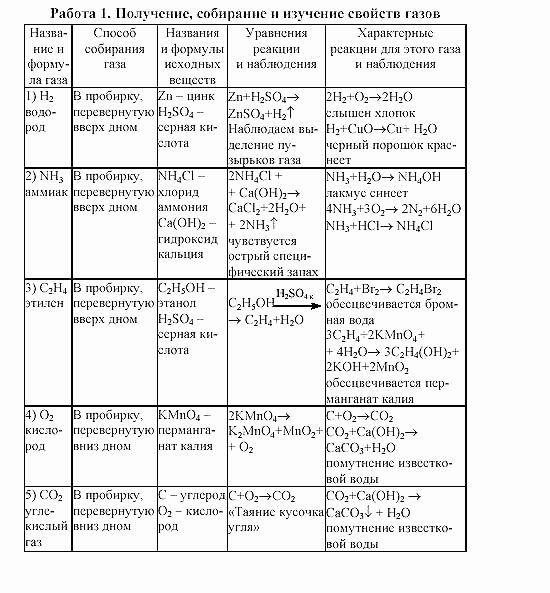 Объясняется это амфотерными свойствами гидроксида алюминия.
Объясняется это амфотерными свойствами гидроксида алюминия.
4. Заключительная часть (3минуты)
Учитель:( предлагает сдать тетради, напоминает, как будет оцениваться работа). Оценка за работу будет выставляться с учетом правильности выполнения практической части работы и отчетов по ее выполнению.
( дается краткая информация по результатам наблюдений за действиями учащихся, указываются ошибки, собираются тетради, учащиеся убирают рабочее место, сдают халаты).
Приложения:
Форма отчета о проделанном опыте.
1.Название опыта, номер заданиями.
2. Цель опыта.
3. Порядок выполнения.
4. Результаты наблюдений.
5. Уравнения реакций .
6. Выводы.
Таблица оценки практических умений учащихся.
( наблюдение осуществляется учителем и лаборантом)
№ |
| Фамилия, имя учащегося |
| Практические умения |
| Проведение опыта, работа с реактивами | Соблюдение порядка на рабочем месте | Уборка рабочего места |
| Соблюдение правил техники безопасности | Соблюдение дисциплины | |||
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
Урок по химии 9 класс «Решение экспериментальных задач по теме «Подгруппа кислорода» | План-конспект урока по химии (9 класс):
Урок по химии для 9 класса
« Практическая работа № 4. Решение экспериментальных задач по теме «Подгруппа кислорода»
Решение экспериментальных задач по теме «Подгруппа кислорода»
Учитель биологии и химии Ступка Лариса Михайловна, АНО СОШ «Академическая гимназия»
Девиз урока: Химии никоим образом научиться невозможно,
не видав самой практики и не принимаясь
за химические операции.
М.В.Ломоносов
Цель : : проверить знания учащихся полученные при изучении темы «Подгруппа кислорода» и закрепить их практически с помощью опытов; продолжить формировать умения и навыки работать с лабораторным оборудованием и реактивами, соблюдая технику безопасности
Задачи:
Образовательные: составлять уравнения химических реакций; повторить правила по ОТ при проведении практической работы и инструкции по ТБ при работе с кислотами, щелочами, лабораторной посудой
Развивающие: развивать познавательный интерес к химии; создать условия для изучения и определения веществ с помощью осуществимых реакций; формировать умение наблюдать, выполнять химические реакции; развивать умение логично мыслить и делать выводы
Воспитательные: формировать умение работать в парах; развивать чувство товарищества и взаимопомощи; воспитывать толерантные отношения в классе
Оборудование и реактивы: штатив для пробирок, пробирки, набор реактивов: серная кислота, соляная кислота, гидроксид натрия, лакмус, хлорид бария, нитрат серебра.
Тип урока: урок закрепление знаний, практическая работа
Формы работы: индивидуальная, парная
Структура урока
1.Организационный этап. Приветствие учащихся. Сообщение темы. Постановка цели урока. Домашним заданием было: подготовиться к практической работе (продумать цель, вещества и их формулы, ход выполнения работы уравнения и выводы). На уроке в тетради записываем число, практическая работа, тема работы, цель, оборудование, реактивы.
Цель для всей работы определяем вместе с учащимися: практически решить задачи по теме «Подгруппа кислорода», соблюдая технику безопасности и оформить работу…
На столе находится оборудование для практической работы. Один из учащихся перечисляет, называет его, остальные записывают в тетрадь.
Напоминание о правилах по ТБ при использовании кислот, щелочей, обращение с лабораторной посудой. Учащиеся делают запись в тетради: с правилами по ТБ ознакомлен
Далее учащиеся вычерчивают в тетради таблицу такого плана:
Выполнение | Наблюдения | Выводы |
2. Проверка теоретического материала. Ответы на тест. Проверка. Самооценка.
Проверка теоретического материала. Ответы на тест. Проверка. Самооценка.
Тест
1)Кислород проявляет положительную степень окисления: а) SO3 б) OF2 в) h3O
2)Бинарные соединения серы с металлами: а) сульфаты б) сульфиды в) сульфиты
3)В техническом хлориде натрия содержится примесь сульфата натрия. Обнаружить эту примесь можно с помощью раствора:
а) соляной кислоты б) серной кислоты в) хлорида бария
4)В качестве сырья для получения серной кислоты в промышленности используют:
а) серу б) сероводород в) пирит
5)Окраска индикатора лакмуса в кислоте: ) синяя б) красная в) желтая
2. Выполнение работы.
Познакомиться с инструкцией проведения эксперимента.
Экспериментальная задача 1. Провести реакции, подтверждающие качественный состав серной кислоты. Написать уравнения реакции.
Экспериментальная задача 2. Даны три номерные пробирки с растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Прежде, чем приступить к выполнению задач, учитель предоставляет слово учащимся для определения цели к каждому опыту, просит одного из учащихся назвать какие вещества будут использованы в работе, остальные записывают в тетрадь.
Далее выслушивается выполнение работы учащимися, с дополнением и уточнением с учетом ТБ. По желанию предоставляется возможность выполнения первой задачи под наблюдением учителя.
Рассказывается выполнение работы задачи 2 и затем учащиеся выполняют.
Экспериментальная задача 3. (дополнительно) Доказать, что поваренная соль содержит примеси сульфата натрия.
3. Закрепление.
По окончании работы учащиеся оформляют отчет о проделанной работе, заполняют таблицу:
Выполнение | Наблюдения | Выводы |
Экспериментальная задача 1. Раствор h3SO4, находящийся в пробирке, делим на 2 части, т.е. отливаем в другую пробирку. В одну пробирку добавляем лакмус Во вторую пробирку приливаем раствор BaCl2 | раствор стал красным, значит среда кислая. Кислая среда определяется наличием ионов H+. h3SO4 + BaCl2 → BaSO4↓ + 2HCl белый 2 H+ + SО42- + Ba 2+ + 2Cl- → BaSO4↓ + 2H+ + 2Cl- Ba2+ + SO4 2- → BaSO4↓ выпадает белый осадок, значит там присутствуют сульфат-ионы. | h3SO4 состоит из ионов H+, т.к. при действии лакмуса раствор красный, это говорит о наличии H+; и из сульфат-ионов, т.к. BaCl2 является качественным реактивом на сульфат-ионы. |
Экспериментальная задача 2. Даны три номерные пробирки с растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Берем пробы из 3х пронумерованных пробирок, т.е. отливаем небольшое количество реактива в чистые пробирки. В эти пробы добавляем лакмус. Допустим это пробирка под № 3. Оставляем ее, т.е. мы ее определили. От оставшихся 2х пробирок вновь берем пробы и в эти пробы добавляем AgNO3 К оставшейся пробирке №2 приливаем BaCl2 | В 2х пробирках раствор красный, в третьей – синий, значит там, где синий раствор – это щелочь, т.е. NaOH. наблюдаем, что в I (допустим) пробирке выпал белый творожистый осадок, значит там находится HCl. HCl + AgNO3 → AgCl↓ + HNO3 белый Н+ + Cl- + Ag+ + NO-3 → AgCl↓ + Н+ + NO-3 Ag+ + Cl- → AgCl↓ выпадает белый осадок, значит там серная кислота. h3SO4 + BaCl2 → BaSo4↓ + 2HCl 2 H+ + SО42- + Ba 2+ + 2Cl- → BaSO4↓ + 2H+ + 2Cl- Ba2+ + SO4 2- → BaSO4↓ | В I пробирке HCl, т. во II — h3SO4, т.к. при действии BaCl2 выпал белый осадок, в III пробирке – NaOH, т.к. при добавлении лакмуса раствор стал синим |
Экспериментальная задача 3. (дополнительно) Доказать, что поваренная соль содержит примеси сульфата натрия. Растворяем соль в воде и приливаем BaCl2 | выпадает белый осадок, значит там серная кислота. h3SO4 + BaCl2 → BaSo4↓ + 2HCl 2 H+ + SО42- + Ba 2+ + 2Cl- → BaSO4↓ + 2H+ + 2Cl- Ba2+ + SO4 2- → BaSO4↓ нет изменений, значит соль не содержит примеси | Поваренная соль содержит ( не содержит примеси сульфата натрия) |
4. Рефлексия.
Работа может быть оценена с учетом подготовки к практической работе, знание ТБ, выполнения опытов и оформления отчета о работе.
Шкала критериев для оценки индивидуальных отчетных заданий:
Знание теоретического материала 1
Знание и владение техникой безопасности при выполнении лабораторных опытов 0,5
Умение применять знания в конкретной практической ситуации 0,5
Оценка собственных действий пребывания в различных ролях (исполнителя, комментатора, контролера) по ходу практической работы 0,5
Умение аргументировать свою позицию относительно различных элементов проводимого эксперимента 0,5
Умение записывать наблюдаемые явления, проводимые химические реакции, оформлять выводы 2
Итого 5
5. Домашнее задание.
Домашнее задание.
Повторить § 18, 19 21; выполнить задание 5 (а,б) , 7 стр. 99
6.Подведение итогов.
Учитель предлагает учащимся проанализировать свою работу на уроке и закончите фразу:
На уроке я работал(а) ____________(хорошо, удовлетворительно, плохо).
Сдать тетрадь на проверку.
« Час работы научит больше, чем день объяснения.» Жан-Жак Руссо
« Те сомнения, которые не разрешает теория, разрешит тебе практика »Людвиг Фейербах
Выполнение экспериментальных задач
Экспериментальная задача 1. Провести реакции, подтверждающие качественный состав серной кислоты. Написать уравнения реакции.
Раствор h3SO4, находящийся в пробирке, делим на 2 части, т.е. отливаем в другую пробирку.
В одну пробирку добавляем лакмус
Во вторую пробирку приливаем раствор BaCl2
Наблюдаем:
раствор стал ———-, значит среда кислая. Кислая среда определяется наличием ионов H+.
h3SO4 + BaCl2 → ? + ?
выпадает ————— осадок, значит там присутствуют сульфат-ионы.
Экспериментальная задача 2. Даны три номерные пробирки с растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Берем пробы из 3х пронумерованных пробирок
т.е. отливаем небольшое количество реактива в чистые пробирки.
В эти пробы добавляем лакмус.
Допустим это пробирка под № 3. Оставляем ее, т.е. мы ее определили. От оставшихся 2х пробирок вновь берем пробы и в эти пробы добавляем AgNO3
К оставшейся пробирке №2 приливаем BaCl2
Наблюдаем:
В 2х пробирках раствор ————, в третьей – ————, значит там, где синий раствор – это ———— .
наблюдаем, что в I (допустим) пробирке выпал белый творожистый осадок, значит там находится HCl.
HCl + AgNO3 = ?+?
выпадает ———— осадок, значит там серная кислота.
h3SO4 + BaCl2 → ?+?
Выводы: Я распознал растворы предложенных веществ на основе знаний о качественных реактивах. Качественным реактивом на серную кислоту и ее соли является …………………, выпадает …………………………… Качественным реактивом на соляную кислоту и ее соли является……………….., выпадает……………………………
Качественным реактивом на серную кислоту и ее соли является …………………, выпадает …………………………… Качественным реактивом на соляную кислоту и ее соли является……………….., выпадает……………………………
Шкала критериев для оценки индивидуальных отчетных заданий:
Знание теоретического материала 1
Знание и владение техникой безопасности при выполнении лабораторных опытов 0,5
Умение применять знания в конкретной практической ситуации 0,5
Оценка собственных действий пребывания в различных ролях (исполнителя, комментатора, контролера) по ходу практической работы 0,5
Умение аргументировать свою позицию относительно различных элементов проводимого эксперимента 0,5
Умение записывать наблюдаемые явления, проводимые химические реакции, оформлять выводы 2
Итого 5
Тест
1)Кислород проявляет положительную степень окисления: а) SO3 б) OF2 в) h3O
2)Бинарные соединения серы с металлами: а) сульфаты б) сульфиды в) сульфиты
3)В техническом хлориде натрия содержится примесь сульфата натрия.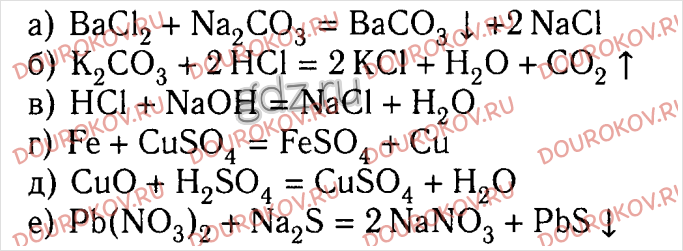 Обнаружить эту примесь можно с помощью раствора:
Обнаружить эту примесь можно с помощью раствора:
а) соляной кислоты б) серной кислоты в) хлорида бария
4)В качестве сырья для получения серной кислоты в промышленности используют:
а) серу б) сероводород в) пирит
5) Окраска индикатора лакмуса в кислоте: ) синяя б) красная в) желтая
Ответы: по 0,2 балла за правильный ответ
- б
- б
- в
- а, в
- б
18 Сногсшибательные идеи для научных проектов 9-го класса
Приближается научная ярмарка для 9-го класса, и все ваши идеи преувеличены и скучны… не смотрите дальше! У нас есть 18 уникальных и креативных научных проектов, которые обязательно произведут впечатление на ваших одноклассников и учителей. От оптических иллюзий до черного света и химических реакций, все, что пробуждает ваше воображение, мы предоставим вам! Давайте экспериментировать!
1. Точное прогнозирование погоды Этот эксперимент работает лучше всего, если у вас есть доступ к метеостанции. В большинстве городов он есть, так что подумайте, можете ли вы брать с него записи для этого эксперимента. Если нет, вы можете вести журнал прогнозов с различных каналов погоды: 1-дневный, 3-дневный, 5-дневный и 7-дневный. Посмотрите, насколько точны прогнозы по сравнению с реальной погодой в реальном времени, чтобы увидеть, насколько точны прогнозы, сообщая публике, чего ожидать.
В большинстве городов он есть, так что подумайте, можете ли вы брать с него записи для этого эксперимента. Если нет, вы можете вести журнал прогнозов с различных каналов погоды: 1-дневный, 3-дневный, 5-дневный и 7-дневный. Посмотрите, насколько точны прогнозы по сравнению с реальной погодой в реальном времени, чтобы увидеть, насколько точны прогнозы, сообщая публике, чего ожидать.
Дополнительная информация: Прогноз погоды
2. Плавающий рисСила трения постоянно окружает нас. Без трения мы бы скользили и скользили, наша еда падала бы, и все было бы в хаосе! Для этого простого научного эксперимента требуется немного риса, бутылка и длинный инструмент, например палочка для еды или карандаш. Наполните бутылку рисом, вставьте внутрь карандаш или палочку и поднимите бутылку, чтобы посмотреть, что произойдет!
Дополнительная информация: плавающий рис
3. Влияние пола на математическую тревожность В этом эксперименте используются некоторые передовые научные концепции, касающиеся контрольной группы, факторов, которые необходимо учитывать, и способов обработки данных и результатов. Один из вариантов проведения этого эксперимента для 9-го класса — приобрести кардиомониторы и попросить каждого ученика носить их на уроке математики и сравнивать их с другими предметами, такими как естествознание или английский язык. запишите результаты и посмотрите, есть ли тенденция между полами и тревогой.
Один из вариантов проведения этого эксперимента для 9-го класса — приобрести кардиомониторы и попросить каждого ученика носить их на уроке математики и сравнивать их с другими предметами, такими как естествознание или английский язык. запишите результаты и посмотрите, есть ли тенденция между полами и тревогой.
Дополнительная информация: гендерная и математическая тревога
4. Гидропонный садБудущее за вертикальными садами? Придумайте гипотезу о том, как, по вашему мнению, гидропоника принесет пользу процессу выращивания сельскохозяйственных культур. Этот инженерный проект требует определенных знаний по уходу за растениями, но, что более важно, готовности построить сложную систему с трубами и соединителями для ваших растений. Могут ли растения действительно расти без почвы? Постройте свой собственный гидропонный сад и узнайте!
Подробнее: Гидропонный сад
5. Радиоприемник с кристаллами С помощью всего нескольких материалов, диода, куска дерева и одного из наушников вы можете слушать музыку из собственного самодельного радиоприемника. Антенны подключены к стержню, который улавливает радиосигналы вокруг вас, а передача энергии происходит через германиевый диод детектора. Есть несколько вариантов, в которых используются разные материалы, которые вам будет проще приобрести. Ознакомьтесь с различными радиостанциями и выберите подходящую для вашей 9 радиостанции.научная ярмарка й степени.
Антенны подключены к стержню, который улавливает радиосигналы вокруг вас, а передача энергии происходит через германиевый диод детектора. Есть несколько вариантов, в которых используются разные материалы, которые вам будет проще приобрести. Ознакомьтесь с различными радиостанциями и выберите подходящую для вашей 9 радиостанции.научная ярмарка й степени.
Дополнительная информация: Самодельное радио
6. Мост из пластиковой бутылкиЭтот эксперимент проверяет наши творческие возможности инженера, чтобы построить мост, на котором ваши одноклассники могут ходить и сидеть, используя пластиковые бутылки и несколько металлических винтов. Разрежьте круглые бутылки и вставьте отрезанные части в донышки целых. Убедитесь, что они надуты и герметичны, и закрутите их вместе.
Подробнее: Бутылочный мост
7. Мяч для разрушения яблок В этом удивительном испытании STEM используются базовые материалы, и вы можете проявить творческий подход к тому, какие детали вы решите использовать. Идея состоит в том, чтобы использовать импульс, силу и инерцию, чтобы маневрировать яблоком, чтобы поразить некоторые объекты. Вы можете выбрать маркеры, маркеры, пустые бутылки или все, что у вас есть. Вы создадите структуру из плотной бумаги, свернутой в цилиндры, и веревки, чтобы связать яблоко.
Идея состоит в том, чтобы использовать импульс, силу и инерцию, чтобы маневрировать яблоком, чтобы поразить некоторые объекты. Вы можете выбрать маркеры, маркеры, пустые бутылки или все, что у вас есть. Вы создадите структуру из плотной бумаги, свернутой в цилиндры, и веревки, чтобы связать яблоко.
Подробнее: Apple Bowling
8. Симбиотические растения и бактерииМогут ли бактерии и растения работать вместе? Как азотфиксирующие бактерии помогают в процессе роста? Ответьте на свои вопросы и проверьте свои гипотезы с помощью этого простого химического эксперимента, используя несколько горшков с почвой, семенами, стерильной инокуляционной петлей и культурой Rhizobium leguminosarum (бактерии). Дайте половине ваших горшков бактерии, а другой половине — ни одного, и посмотрите, какие семена вырастут лучше.
Дополнительная информация: Бактерии и растения
9. Химия разноцветного огня Хотите, чтобы из горелки Бунзена вырывалось пламя разных цветов? Какой химический процесс стоит за изменением цвета? Для этого школьного проекта научной ярмарки вам нужно будет выбрать химические вещества, которые вы хотите протестировать (можно использовать химические вещества из аптеки), затем взять металлический стержень и запустить его под холодную воду, окунув его в химическое вещество, которое вы тестируете, например, в натрий. хлористый. Запишите свои результаты и посмотрите, какие химические вещества изменяют цвет пламени.
хлористый. Запишите свои результаты и посмотрите, какие химические вещества изменяют цвет пламени.
Подробнее: Радужный огонь
10. Факторы изучения второго языкаЭтот социологический эксперимент проверяет, влияет ли пол, родной язык или возраст на то, как мы изучаем второй язык. Создайте свою собственную гипотезу относительно своих прогнозов и проверьте ее на учениках средней школы, старшеклассниках, детях и взрослых.
Дополнительная информация: Изучение второго языка
11. Цветные и черно-белые оптические иллюзииКакие оптические иллюзии труднее увидеть в цвете или в черно-белом? Какую роль играет цвет в том, как мы воспринимаем вещи глазами, облегчает ли он различение или затрудняет замечание небольших различий? Найдите похожие оптические иллюзии в цвете и черно-белом цвете и покажите их людям и время, за которое они решают задачу.
Дополнительная информация: оптические иллюзии и цвет
12. Автомобиль с резиновой лентой
Автомобиль с резиновой лентой В этом забавном инженерном проекте используются бумажные стаканчики, резинки, скрепка, маленькая шайба и одна палочка для еды. После того, как вы соберете его, вы будете крутить палочки для еды вокруг резинок. Это изменит потенциальную энергию, хранящуюся в резинках, на кинетическую энергию и заставит вашу маленькую машинку взлететь!
Дополнительная информация: Кинетическая машина
13. ЗемлетрясениеВ этом классном научном эксперименте проверяется, как статическое трение работает для создания разрушения, подобного землетрясению, с использованием природных материалов. Возьмите несколько стандартных кирпичей и посмотрите, какое усилие требуется, чтобы они соприкасались друг с другом. Изменяйте элементы управления, добавляя вес, изменяя трение и рассматривая математику, стоящую за этими стихийными бедствиями.
Дополнительная информация: Математика землетрясений
14. Судебно-медицинская экспертиза отпечатков пальцев
Судебно-медицинская экспертиза отпечатков пальцев Этот проект научной ярмарки 9-го класса рассказывает о том, как криминалисты находят отпечатки пальцев на поверхностях для преступлений и других целей. Теперь вы сами можете разгадывать тайны с помощью соляной кислоты и своих маслянистых пальцев. Соляная кислота вступает в реакцию с аминокислотами в вашей коже, и ваши отпечатки пальцев светятся зеленым, так здорово!
Дополнительная информация: наука об отпечатках пальцев
15. Воздействие антибиотиков на бактерииКак наиболее распространенные антибиотики реагируют с грамположительными и грамотрицательными бактериями? Возьмите немного бактерий с кожи или изо рта и поместите их в чашку Петри. Добавляйте разные антибиотики в каждую посуду и берите контрольную посуду. Посмотрите, как антибиотики реагируют с бактериями, и запишите свои результаты.
Дополнительная информация: антибиотики и бактерии
16. Светящаяся вода
Светящаяся вода Этот простой эксперимент обязательно принесет вам восторженные отзывы в 9научная ярмарка й степени. Вам понадобится маркер, черный свет, тоник и темная комната. Откройте хайлайтер и смочите войлочную часть тоником. Принесите воду в темную комнату, поместите ее рядом с черной лампой и посмотрите, как она светится!
Подробнее: Светящийся тоник
17. Конфетная лабораторияВ этом эксперименте рассматривается одна захватывающая концепция молекулярных вычислений в химии, которая позволяет создавать лабораторные конфеты со вкусом мяты для ваших одноклассников. Вам понадобится алюминиевая банка, горелка Бунзена и сырье, которое в конечном итоге станет вашей конфетой!
Дополнительная информация: Candy Labs
18. Дождь или снег: что кислее? В этом эксперименте кислотный дождь сравнивается с кислотным снегом, чтобы определить, какой из них имеет более низкий pH. Более низкий pH означает, что что-то более кислое. Используя индикаторную бумагу, возьмите образцы различных источников воды, дождя, снега и мокрого снега и протестируйте их на бумаге, чтобы узнать, каков их уровень рН.
Более низкий pH означает, что что-то более кислое. Используя индикаторную бумагу, возьмите образцы различных источников воды, дождя, снега и мокрого снега и протестируйте их на бумаге, чтобы узнать, каков их уровень рН.
Дополнительная информация: кислотные типы воды
23 лучших научных проекта и экспериментов 9-го класса
Распространяйте любовь
Вы ищете научные занятия для своих второклассников? Нет пота. Мы вас прикрыли. Ознакомьтесь с нашим списком из 23 научных проектов и экспериментов, которые вы можете провести со своими девятиклассниками в этом месяце.
- Плотный фрукт — полезный фрукт? | Education.com — классы 9–12. В этом эксперименте учащиеся узнают, существует ли связь между плотностью и питательной ценностью, путем измерения плотности овощей и фруктов.
- Влияние глюкозы и сахарозы в качестве пищевых добавок | Education.com – 9–12 классы. Учащиеся изучают, влияет ли глюкоза на продолжительность жизни человека и как.

- Влияние кислотных дождей на прорастание рассады | Education.com – 9-12 классы, Оказывают ли кислотные дожди положительное или отрицательное влияние на прорастание рассады? В этом проекте учащиеся используют растворы на основе уксуса, чтобы имитировать кислотные дожди.
- Эффективность чеснока в борьбе с бактериями | All-Science-Fair-Projects.com — 9-12 классы, Используйте молоко в чашках Петри, чтобы узнать, является ли чеснок природным антибиотиком.
- Как растут корни при изменении направления силы тяжести? | ScienceBuddies.org — Классы 6-10, Растения реагируют на гравитацию стеблями, которые растут вверх, и корнями, которые растут вниз. Поэкспериментируйте с прорастающими семенами и вращайте их, чтобы получить вверх вниз и вниз вверх. Как вы думаете, как отреагируют растущие саженцы?
- Построить плот на основе поверхностного натяжения | Sciencebuddies.org – 6–10 классы.
 Узнайте о свойствах поверхностного натяжения воды и используйте его для движения плота.
Узнайте о свойствах поверхностного натяжения воды и используйте его для движения плота. - Предпочтение лап в домашних животных | Sciencebuddies.org – 7-10 классы, Животные левши или правши, как люди?
- Детектор летучих мышей: послушайте тайные звуки летучих мышей | Sciencebuddies.org – 7–10 классы, изучайте поведение летучих мышей, чтобы узнать, как они используют эхолокацию для поимки добычи
- Спасение перелетных животных | ScienceBuddies.org — 7–10 классы. Сегодня они здесь, но завтра их может не быть. Изучите миграционные пути видов птиц, а также сходства и различия между их зимними и летними местами обитания. Порекомендуйте, какие места следует сохранить для защиты этих видов.
- Электрический ветер: высокоскоростные потоки заряженного воздуха | Scienceclub.org – 9–12 классы. Используйте сухой лед и электростатический генератор для наблюдения за воздушными потоками и высокоскоростными воздушными потоками.

- Оценка закона Бенфорда | Образование.com – 9-12 классы. В этом проекте учащиеся исследуют применимость Закона Бенфорда ко многим наборам повседневных данных, таким как списки населения страны, счета за коммунальные услуги или расстояние от различных звезд до Земли.
- Выкройки в J.S. Бах | Education.com – 9–12 классы. Определите математические закономерности в двухчастных прелюдиях и фугах И. С. Баха.
- Сырые и приготовленные продукты | Education.com – 9–12 классы, Содержат ли сырые продукты больше калорий, чем приготовленные? Используйте бомбовый калориметр, чтобы измерить и рассчитать количество энергии (калорий) в различных продуктах, поджечь образцы продуктов, рассчитать изменение температуры.
- Химия производства мороженого | Sciencebuddies.org — 9–12 классы. Проверьте, как добавление соли и других веществ в воду влияет на температуру замерзания раствора на водной основе.
 Является ли каменная соль и лед лучшей комбинацией для замораживания мороженого?
Является ли каменная соль и лед лучшей комбинацией для замораживания мороженого? - Вода в топливо в воду | ScienceBuddies.org Классы 9-12, Изучите возможности использования воды как части топливного цикла в будущем. Насколько эффективен катализатор на основе кобальта для образования молекулярного кислорода?
- Левитация с вихревыми течениями! | Sciencebuddies.org — 9–12 классы. Создайте собственную систему maglev (магнитной левитации) и продемонстрируйте, как работают вихревые токи.
- Ваш сотовый телефон протекает? | Sciencebuddies.org — 9–12 классы. Измеряйте излучение сотового телефона с разных расстояний при звонках и текстовых сообщениях.
- Реконструкция маяка | Education.com — 9–12 классы. Старые маяки имеют историческое значение. Подарите им новую жизнь с современным дизайном интерьера.
- Свет и звуки логики | Иллинойский технологический институт – классы 9–12.
 Цифровая электроника, такая как смартфоны и компьютеры, работает на основе встроенной логики. Используйте схемы, которые светятся и издают звук, чтобы показать, как работает эта базовая логика.
Цифровая электроника, такая как смартфоны и компьютеры, работает на основе встроенной логики. Используйте схемы, которые светятся и издают звук, чтобы показать, как работает эта базовая логика. - Орегаметрия | Education.com – 9–12 классы. Используйте математику складывания бумаги, чтобы изучить практическое применение определенных методов складывания оригами. Создайте свое собственное оригами или внесите изменения в существующие конструкции. Origami Sightings имеет несколько умопомрачительных применений концепций оригами.
- Извлечение тепловой энергии из компостной кучи | Sciencebuddies.org — 9–12 классы. Используйте кожуру бананов, газеты, листья и кофейную гущу для создания компоста. Узнайте, достаточно ли энергии вырабатывается из компоста для нагрева воды.
- Охлаждают ли океан ураганы? | Sciencebuddies.org — 9–12 классы. Сбор данных о силе урагана и температуре поверхности моря, чтобы определить, происходит ли охлаждение и можно ли его измерить при прохождении урагана.



 Провести реакции, подтверждающие качественный состав серной кислоты. Написать уравнения реакции.
Провести реакции, подтверждающие качественный состав серной кислоты. Написать уравнения реакции. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Написать уравнения соответствующих реакций в молекулярном и ионном виде. к. при действии AgNO3 выпадает белый творожистый осадок,
к. при действии AgNO3 выпадает белый творожистый осадок,
 Узнайте о свойствах поверхностного натяжения воды и используйте его для движения плота.
Узнайте о свойствах поверхностного натяжения воды и используйте его для движения плота.
 Является ли каменная соль и лед лучшей комбинацией для замораживания мороженого?
Является ли каменная соль и лед лучшей комбинацией для замораживания мороженого? Цифровая электроника, такая как смартфоны и компьютеры, работает на основе встроенной логики. Используйте схемы, которые светятся и издают звук, чтобы показать, как работает эта базовая логика.
Цифровая электроника, такая как смартфоны и компьютеры, работает на основе встроенной логики. Используйте схемы, которые светятся и издают звук, чтобы показать, как работает эта базовая логика./001.jpg)