Химия. 9 класс. Технологические карты – технологическая карта урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
авторы: Асанова Лидия Ивановна, Кандидат педагогических наук,доцент кафедры естественнонаучного образования ГБОУ ДПО «Нижегородский институт развития образования»
Технологические карты уроков
Основное общее образование
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Пособие предназначено для учителей химии, работающих в общеобразовательных организациях по учебнику «Химия. 9 класс» О. С. Габриеляна.
Содержит технологические карты уроков, в которых представлены обобщенные планируемые образовательные результаты (предметные, метапредметные, личностные), организационная структура и ход уроков.
Пособие адресовано учителям химии, кроме того, оно может быть использовано в учебном процессе для химико-методической подготовки студентов, а также в системе повышения квалификации педагогов.
Содержание
- Общая характеристика химических элементов и химических реакций
- Уроки 1–2. Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева
- Урок 3. Характеристика химического элемента по кислотно-осно́вным свойствам. Амфотерные оксиды и гидроксиды
- Урок 4. Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома
- Урок 5. Классификация химических реакций
- Урок 6. Понятие о скорости химической реакции
- Урок 7. Катализаторы и катализ
- Уроки 8–9. Обобщение и систематизация знаний по теме «Общая характеристика химических элементов и химических реакций»
- Урок 10. Общая характеристика химических элементов и химических реакций. Диагностическая работа
- Металлы
- Урок 11. Положение элементов-металлов в Периодической системе химических элементов Д.
 И. Менделеева и строение их атомов. Физические свойства металлов. Сплавы
И. Менделеева и строение их атомов. Физические свойства металлов. Сплавы - Урок 12. Химические свойства металлов
- Урок 13. Металлы в природе. Получение металлов
- Урок 14. Понятие о коррозии металлов
- Уроки 15–16. Щелочные металлы
- Уроки 17–18. Бериллий, магний и щелочноземельные металлы
- Уроки 19–20. Алюминий
- Уроки 21–22. Железо
- Урок 23. Обобщение и систематизация знаний по теме «Металлы»
- Урок 24. Металлы. Диагностическая работа
- Урок 11. Положение элементов-металлов в Периодической системе химических элементов Д.
- Химический практикум № 1. Свойства металлов и их соединений
- Урок 25. Осуществление цепочки химических превращений. Практическая работа
- Урок 26. Экспериментальные задачи на распознавание и получение соединений металлов. Практическая работа
- Неметаллы
- Урок 27. Неметаллы: атомы и простые вещества. Кислород, озон, воздух
- Урок 28.
 Водород
Водород - Урок 29. Вода
- Урок 30. Галогены
- Урок 31. Соединения галогенов. Получение галогенов
- Урок 32. Кислород
- Урок 33. Сера
- Урок 34. Соединения серы
- Урок 35. Серная кислота как электролит. Соли серной кислоты
- Урок 36. Серная кислота как окислитель. Получение и применение серной кислоты
- Урок 37. Азот и его свойства
- Уроки 38–39. Аммиак и его свойства. Соли аммония
- Урок 40. Оксиды азота. Азотная кислота как электролит
- Урок 41. Азотная кислота как окислитель. Соли азотной кислоты
- Урок 42. Фосфор и его соединения
- Урок 43. Углерод
- Урок 44. Оксиды углерода
- Урок 45. Угольная кислота и ее соли. Жесткость воды и способы ее устранения
- Урок 46. Кремний
- Урок 47. Соединения кремния
- Урок 48. Силикатная промышленность
- Урок 49.
 Обобщение и систематизация знаний по теме «Неметаллы»
Обобщение и систематизация знаний по теме «Неметаллы» - Урок 50. Неметаллы. Диагностическая работа
- Химический практикум № 2. Свойства соединений неметаллов
- Урок 51. Экспериментальные задачи по теме «Подгруппа кислорода». Практическая работа
- Урок 52. Экспериментальные задачи по теме «Подгруппы азота и углерода». Практическая работа
- Урок 53. Получение, собирание и распознавание газов. Практическая работа
- Начальные сведения об органических соединениях
- Урок 54. Углеводороды
- Уроки 55–56. Кислородсодержащие органические соединения
- Урок 57. Азотсодержащие органические соединения
- Обобщение знаний по химии за курс основной школы. Подготовка к ОГЭ
- Урок 58. Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете теории строения атома
- Урок 59.
 Виды химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ
Виды химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ - Урок 60. Классификация химических реакций по различным признакам. Скорость химических реакций
- Урок 61. Диссоциация электролитов в водных растворах. Ионные уравнения реакции
- Урок 62. Окислительно-восстановительные реакции
- Урок 63. Классификация и свойства неорганических веществ
- Уроки 64–65. Тренинг-тестирование по вариантам ОГЭ прошлых лет и демоверсии
- Список литературы
Асанова Лидия Ивановна
Кандидат педагогических наук,доцент кафедры естественнонаучного образования ГБОУ ДПО «Нижегородский институт развития образования»
Хотите сохранить материал на будущее? Отправьте себе на почту
в избранноеТолько зарегистрированные пользователи могут добавлять в избранное.
Войдите, пожалуйста.
Учебные издания по теме
Купить
ГДЗ по Химии для 9 класса Усманова М.
 Б., Сакарьянова К.Н., Сахариева Б.Н. на 5 ГДЗ по Химии для 9 класса Усманова М.Б., Сакарьянова К.Н., Сахариева Б.Н. на 5
Б., Сакарьянова К.Н., Сахариева Б.Н. на 5 ГДЗ по Химии для 9 класса Усманова М.Б., Сакарьянова К.Н., Сахариева Б.Н. на 5Часто ищут
- Русский язык 9 класс Алгоритм успеха
- Авторы: Шмелев А.Д., Флоренская С.Н., Митюрев С.Н.
- Издательство: Вентана-граф 2016
- Химия 9 класс
- Авторы: Г.

- Издательство: Просвещение 2016
- Черчение 9 класс
- Автор: В. Н. Виноградов
- Издательство: Национальный институт образования 2014
- Английский язык 9 класс Spotlight
- Авторы: В.
 Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина
Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина - Издательство: Просвещение 2015
- Английский язык 9 класс Starlight Углубленный уровень
-
- Издательство: Просвещение 2017
- Обществознание 9 класс
- Авторы: Данилов Д.
 Д., Сизова Е.В., Давыдова С.М., Николаева А.А., Корпачева Л.Н.
Д., Сизова Е.В., Давыдова С.М., Николаева А.А., Корпачева Л.Н. - Издательство: Баласс 2016
- Английский язык 9 класс Книга для чтения Углубленный уровень
- Авторы: Афанасьева О.В., Михеева И.В.
- Издательство: Просвещение 2016
- Алгебра 9 класс Задачник Базовый уровень
- Авторы: Мордкович А.
 Г., Семенов П.В.
Г., Семенов П.В. - Издательство: Мнемозина 2015-2021
- Физика 9 класс
- Авторы: А.В. Перышкин, А.И. Иванов
- Издательства: Экзамен, Просвещение, Дрофа 2014-2021
Структура атома — Класс 9 Научные заметки
Открытие атомов было революционным началом нового и подробного мира науки. Каким бы маленьким ни был атом, внутри него заключено множество важных понятий. Это должным образом объяснено в главе «Структура атома» класса 9. Эта глава познакомит вас с такими важными темами, как фундаментальные составляющие атома, различные модели атома, распределение электронов, валентности, атомный номер и массовое число. Итак, давайте начнем и рассмотрим эту тему программы CBSE класса 9.
Это должным образом объяснено в главе «Структура атома» класса 9. Эта глава познакомит вас с такими важными темами, как фундаментальные составляющие атома, различные модели атома, распределение электронов, валентности, атомный номер и массовое число. Итак, давайте начнем и рассмотрим эту тему программы CBSE класса 9.
Этот блог включает в себя:
- Fundamental Constituents of an Atom
- Electron
- Protons
- Neutrons
- Atomic Structure of Carbon
- Atomic Structure of Oxygen
- Atomic Structure of Hydrogen
- Atomic Structure of Helium
- Different Models on Structure of атом
- Thomson’s Model of an Atom
- Rutherford’s Model of an Atom
- Bohr’s Model of an Atom
- Distribution of Electrons in Distinct Shells
- Valency
- Atomic Number (Z)
- Mass Number (A)
- Isotopes and Изобары
- Изотопы
- Изобары
- Важные вопросы и ответы
- Часто задаваемые вопросы
Класс 9 Программа ICSE по химии 90 06014 Класс 9 ICSE Maths Атом состоит из трех основных частиц, а именно протонов, нейтронов и электронов. Дж. Дж. Томсон в 1897 году обнаружил отрицательно заряженные частицы, испускаемые катодом по направлению к аноду, в эксперименте с электронно-лучевым излучением. Эти отрицательно заряженных частиц — это электроны. Эрнест Гольдштейн в 1886 году обнаружил, что при различных условиях в той же камере анод испускает положительно заряженных частиц, известных как канальные лучи или позже названных протонами. Дж. Чедвик открыл субатомную частицу с без заряда и массой, эквивалентной протонам в ядрах всех атомов. Эти нейтрально заряженные частицы — нейтроны. Атом углерода содержит шесть протонов, шесть электронов и шесть нейтронов, что составляет его массовое число 12. Атом кислорода содержит восемь протонов, восемь электронов и восемь нейтронов, составляющих его массу. номер 16. Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Атом гелия содержит два протона, два электрона и два нейтрона, что делает его массовое число равным 2. Фундаментальная единица жизни Класс 9 Примечания Со времени открытия атомов существует множество теорий, которые были сформулированы многими известными учеными. Упомянутые ниже важные теории о структуре атома в соответствии с главой. Дж. Недостатки модели Томсона: Томсоновская структура атома не смогла объяснить расположение протонов и электронов в его структуре. Класс 9: Работа, энергия и мощность Примечания Резерфорд провел эксперимент по бомбардировке альфа-(α)-частицами золотой фольги. Это постулаты, высказанные Резерфордом с использованием эксперимента по рассеянию альфа-(α)-частиц на золотой фольге. Недостатки модели: Хотя Резерфорд представил совершенно новую модель строения атома, было много недостатков, которые он не смог объяснить, а именно: Формат написания сюжета для класса 9 Класс 9 ICSE Physics 7
Основные составляющие атома
 Ядро атома содержит протоны и нейтроны, где протоны заряжены положительно, а нейтроны нейтральны. Электроны расположены в самых внешних областях, называемых электронной оболочкой.
Ядро атома содержит протоны и нейтроны, где протоны заряжены положительно, а нейтроны нейтральны. Электроны расположены в самых внешних областях, называемых электронной оболочкой. Электрон
Протоны
Нейтроны
Атомная структура углерода

Атомная структура кислорода
Атомная структура водорода
Атомная структура гелия
Различные модели строения атома
Модель атома Томсона
 Дж. Томсон предположил, что структура атома аналогична структуре рождественского пудинга, где электроны встроены в сферу, как смородина. Он предложил:
Дж. Томсон предположил, что структура атома аналогична структуре рождественского пудинга, где электроны встроены в сферу, как смородина. Он предложил: Модель атома Резерфорда
 Он наблюдал траекторию альфа (α)-частиц после прохождения через атом и сформулировал некоторые постулаты эксперимента, а именно: любая помеха
Он наблюдал траекторию альфа (α)-частиц после прохождения через атом и сформулировал некоторые постулаты эксперимента, а именно: любая помеха
Кредиты: AMRITACREATE Когда электроны вращаются, они теряют энергию. Вскоре электроны сколлапсируют в ядро. Эта тенденция сделала бы атом очень нестабильным, в то время как атом очень стабилен
Когда электроны вращаются, они теряют энергию. Вскоре электроны сколлапсируют в ядро. Эта тенденция сделала бы атом очень нестабильным, в то время как атом очень стабилен Модели Bohr’s Model at Atom
9001
Модели Bohr’s Model at Atom
9001. которую подняла модель Резерфорда. Итак, он сформулировал следующие постулаты:- Атом допускает только дискретное количество орбиталей для электронов на орбите и образует внешнюю структуру атома
- При вращении отрицательно заряженные частицы не теряют энергию на этих орбиталях или энергетических уровнях
- Когда электрон перескакивает с одной энергетической оболочки на другую, происходит изменение величины
Модель Бора дает подробное объяснение строения атома и преодолевает возражения, с которыми сталкиваются все другие модели строения атома.
Распределение электронов по различным оболочкам
92 дает размещение максимального количества электронов в каждой оболочке, n=1, 2, 3, 4 для K=2, L=8, M=18, N=32 . Количество электронов в K-оболочке: n = 1
2n 2 = 2 × 1 2 = 2
Максимальное количество электронов в 92 число электронов на любой оболочке можно рассчитать.
Валентность
Следующим важным понятием в наших заметках о структуре атома является валентность. Отрицательно заряженные частицы, присутствующие во внешней оболочке, называются валентными электронами. Эти валентные электроны отвечают за валентность атома.
Валентность – это склонность атома реагировать с другими атомами того же или различных элементов. Атомы, которые заполняют крайние пути, проявляют химическую активность по отношению к другим валентным электронам. Эта реакционная способность отвечает за образование молекул между двумя или более атомами.
Атомы, которые заполняют крайние пути, проявляют химическую активность по отношению к другим валентным электронам. Эта реакционная способность отвечает за образование молекул между двумя или более атомами.
Валентность становится нулевой для атома, когда внешние границы имеют восемь электронов или не теряют ни одного электрона. Частица с восемью электронами на самой внешней оболочке представляет собой октет, и эти молекулы в основном инертны по своей природе.
Магний (Mg) имеет конфигурацию (2, 8 и 2), поэтому валентность два . Кислород (O) (2, 8 и 6) имеет валентность две , так как количество электронов, которое он может получить, равно двум для достижения упакованного внешнего энергетического уровня. Точно так же Гелий (Не) имеет 2 электрона во внешней оболочке, Неон (Ne) (2, 8 и 8) имеет восемь электронов во внешней оболочке.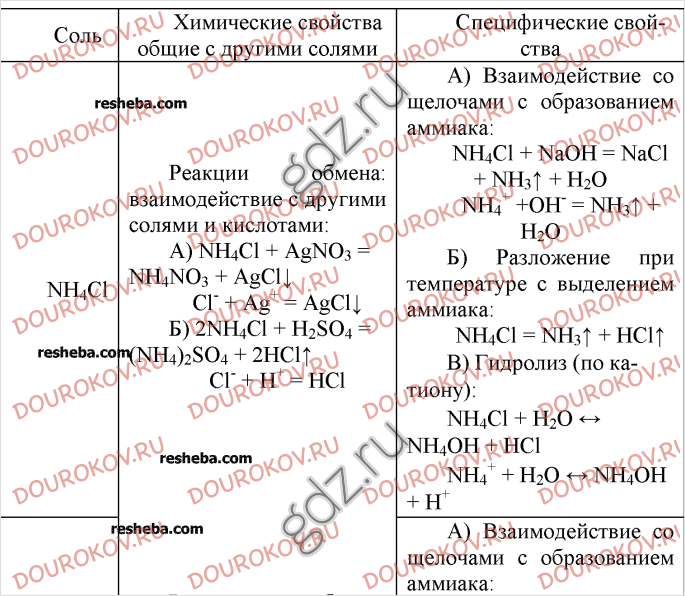 Следовательно, они не проявляют никакой химической активности.
Следовательно, они не проявляют никакой химической активности.
Примеры химии в повседневной жизни
Атомный номер (Z)
Ядро атома состоит из протонов , а атомный номер равен числу протонов, присутствующих в одном атоме элемента . Поскольку атом электрически нейтрален, количество протонов и электронов одинаково. Обозначение Z обозначает атомный номер. Атомный номер водорода равен единице, поскольку он имеет только один протон.
Понимание этих основных моментов главы структуры атома будет полезно для вас-
Количество протонов, присутствующих в атоме = Атомный номер (Z)
Количество электронов, присутствующих в атоме = Атомный номер ( Z)
Количество нейтронов = Массовое число (A)- Атомный номер (Z)
Массовое число (A)
Массовое число является мерой общего числа протонов и нейтронов в ядре атома. Обозначение A указывает на массовый номер . Обозначение N означает общее число нейтронов .
Обозначение A указывает на массовый номер . Обозначение N означает общее число нейтронов .
Массовое число = Атомный номер + Количество нейтронов в ядре
A = Z + n°
Массовое число также называют нуклонным числом.
Изотопы и изобары
Изотопы и изобары — важные понятия, которые вы должны понимать, чтобы лучше понять главу.
Изотопы
Атомы одних и тех же элементов с одинаковым атомным номером и разными массовыми числами. Водород имеет три изотопа: Протий, Дейтерий, Тритий .
Примеры:
Изобары
Атомы разных молекул с одинаковым массовым числом. Например, в кальции с атомным номером 20 и аргоне с атомным номером 18 массовое число обоих этих элементов равно 40. Это показывает, что общее число нуклонов в атомах одинаково.
Примеры:
Важные вопросы и ответыQ1. Назовите свойства электронов, протонов и нейтронов.
Сол:
| Недвижимость | Электроны | Протоны | Нейтроны |
| Плата | Отрицательно заряженный | Положительно заряженный | Бесплатно |
| Аффинити | Притягивается к положительно заряженным | Притягивается к отрицательно заряженным | Не привлекайте ни положительное, ни отрицательное |
| Вес | Масса пренебрежимо мала | 1 час ночи | 1 час ночи |
| Местоположение | Вне ядра | Внутри ядра | Внутри ядра |
Q2. Опишите ограничения модели атома Дж. Дж. Томсона.
Сол: Согласно этой модели, электроны полностью погружены в положительно заряженные сферы. Но эксперименты показали, что протоны присутствуют только в центре атома, а электроны распределены вокруг ядра атома.
Q3. Укажите ограничения модели атома Резерфорда.
Sol: Согласно этой модели, электроны вращаются по круговой орбите вокруг ядра. Любая такая частица, вращающаяся вокруг ядра, претерпевала бы ускорение и излучала бы энергию. Вращающийся электрон потерял бы свою энергию и в конце концов упал бы на ядро, атом был бы крайне нестабилен. Хотя атомы достаточно стабильны.
Q4. Опишите модель атома Бора.
Sol: проверьте следующие утверждения:
- В центре атома находится ядро.
- Отрицательно заряженные электроны вращаются вокруг ядра.
- Атомы ядра содержат различные орбиты электронов.
- Электроны не излучают энергию при вращении по определенным орбитам
- Эти орбиты или оболочки обозначаются буквами K,L,M,N или цифрами 1,2,3,4.

Q5. Приведите сравнение всех предложенных моделей атома, приведенных в этой главе.
Сол:
| Томсон | Резерфорд | Бор |
| Сфера заряжена положительно. | Положительно заряженная сфера в центре называется ядром. | Положительный заряд в центре называется ядром. |
| Электроны вращаются вокруг ядра по орбитам. | Электроны вращаются по дискретным орбитам и не излучают энергию. | |
| Положительный заряд = Отрицательный заряд. Атом электрически нейтрален. | Размер ядра очень мал по сравнению с размером атома. | Орбиты обозначались как энергетические оболочки буквами K, L, M, N или цифрами 1,2,3,4. |
Кредиты: Britannica Модель атома Резерфорда
Кредиты: Модель атома COCCBohr
Кредиты: Classnotes
Часто задаваемые вопросы
Как лучше всего описать структуру атома?
Базовая структура атома включает крошечное относительно массивное ядро, содержащее по крайней мере один протон и обычно один или несколько нейтронов . Вне ядра находятся энергетические уровни (также называемые оболочками), которые содержат один или несколько электронов.
Вне ядра находятся энергетические уровни (также называемые оболочками), которые содержат один или несколько электронов.
Можно ли уничтожить атом?
Согласно закону сохранения энергии материя не может быть ни создана, ни уничтожена. Следовательно, атом не может быть разрушен и не может быть разбит на более мелкие частицы.
Какие 3 части атома?
Учитывая, что эти частицы состоят из атомов, их часто называют субатомными частицами. Есть три субатомные частицы: протоны, нейтроны и электроны.
Таким образом, мы надеемся, что этот блог о структуре атома поможет вам лучше понять учебный план по естественным наукам класса 9 . Вы также можете обратиться к нашим экспертам Leverage Edu за помощью в принятии важных карьерных решений.
Абзац, эссе и речь на тему «Важность химии» Параграф для 9-го, 10-го, 12-го классов и выпускных экзаменов.

Важность химии
Введение
Химия — одна из фундаментальных наук. Знание химии необходимо для изучения любой другой науки. Нам это нужно для изучения технологии, фармакологии, минералогии и многого другого. Он незаменим при изучении физики, геологии, биологии и физиологии. Следовательно, это обязательный предмет изучения для каждого студента, изучающего естественные науки.
В современную индустриальную эпоху эта важность ощущается еще более широко. Он необходим в мастерских, в лабораториях, в медицинских клиниках, на сельскохозяйственных угодьях, а также в различных производственных процессах.
Было бы почти невозможно перечислить все области науки, в которых требуются услуги химика или сферы применения этой науки. Мы укажем на некоторые из наиболее важных, чтобы показать, насколько это необходимо.
Важность химии
Мы живем в век синтетических продуктов. Повышенный спрос на различные натуральные продукты и тот факт, что они не могут быть легко доступны везде, привели к новому развитию в мире химии. Сегодня натуральные продукты часто создаются искусственно с помощью химических процессов. Натуральный индиго полностью вытеснен эквивалентными синтетическими красителями. Натуральный шелк, изготовленный перед коконом, является дорогостоящим продуктом и не всегда доступен во всех климатических условиях. Это дало начало большой промышленности искусственного шелка, называемого вискозой или нейлоном или другими запатентованными названиями. Во время производства шелка оккупация японцами великой страны-производителя каучука Малайзии привела к развитию производства искусственного каучука. Еще одна отрасль, полная бесконечных возможностей, — это пластмассы. Нет ничего, что нельзя было бы сделать из пластика — от одежды до зданий. Эти примеры дадут представление о той роли, которую химия будет играть в грядущей новой эпохе.
Повышенный спрос на различные натуральные продукты и тот факт, что они не могут быть легко доступны везде, привели к новому развитию в мире химии. Сегодня натуральные продукты часто создаются искусственно с помощью химических процессов. Натуральный индиго полностью вытеснен эквивалентными синтетическими красителями. Натуральный шелк, изготовленный перед коконом, является дорогостоящим продуктом и не всегда доступен во всех климатических условиях. Это дало начало большой промышленности искусственного шелка, называемого вискозой или нейлоном или другими запатентованными названиями. Во время производства шелка оккупация японцами великой страны-производителя каучука Малайзии привела к развитию производства искусственного каучука. Еще одна отрасль, полная бесконечных возможностей, — это пластмассы. Нет ничего, что нельзя было бы сделать из пластика — от одежды до зданий. Эти примеры дадут представление о той роли, которую химия будет играть в грядущей новой эпохе.
Союзник медицины: В медицине использование химии имеет основополагающее значение. Людей, которые выдают рецепты врачей, по праву называют «химиками». Химические исследования идут рука об руку с медицинскими исследованиями. Таким образом, развитие органической химии произвело революцию в основе современной медицины. Открытие чудо-лекарств, таких как пенициллин и стрептомицин, и применение химии красителей в терапии принесли человечеству неоценимую пользу.
Людей, которые выдают рецепты врачей, по праву называют «химиками». Химические исследования идут рука об руку с медицинскими исследованиями. Таким образом, развитие органической химии произвело революцию в основе современной медицины. Открытие чудо-лекарств, таких как пенициллин и стрептомицин, и применение химии красителей в терапии принесли человечеству неоценимую пользу.
Как это помогает Диетология: Новая наука о витаминах повысила важность химии пищевых продуктов. Нехватка продовольствия во время войны привела к изобретению различных концентрированных химических пищевых продуктов и помогла восполнить недостатки в качестве и составе продуктов питания. Конечно, химическая пища никогда не сможет заменить натуральную пищу, но она является важным дополнением к нашему рациону. Наука биохимия действительно превратилась в важную отрасль химии, значение которой по отношению к феномену жизни полно возможностей.
В помощь сельскому хозяйству: Использование химии для земледельцев также очень велико. Химические удобрения эффективно укрепляют примитивные формы навоза, значительно обогащая почву. Действительно, химия почвы является плодотворным предметом изучения и исследований, особенно в такой сельскохозяйственной стране, как Индия. В России при каждом хозяйстве закреплена химическая лаборатория, в которой проводятся непрерывные исследования удобрений и стимуляторов роста. Мы также открываем лаборатории по сбору урожая, чтобы помочь фермеру.
Химические удобрения эффективно укрепляют примитивные формы навоза, значительно обогащая почву. Действительно, химия почвы является плодотворным предметом изучения и исследований, особенно в такой сельскохозяйственной стране, как Индия. В России при каждом хозяйстве закреплена химическая лаборатория, в которой проводятся непрерывные исследования удобрений и стимуляторов роста. Мы также открываем лаборатории по сбору урожая, чтобы помочь фермеру.
Как оружие разрушения. Вклад химической науки в военную науку, связанную с разрушением, так же велик, как и ее творческая сторона. Это помогло крупномасштабному производству глицерина и азотной кислоты и тем самым стимулировало производство высококачественных взрывчатых веществ во все возрастающих количествах. Он создал ядовитые газы, которые представляют постоянную угрозу существованию человечества. Мы живем каждый день в страхе, что какая-то отчаявшаяся нация, зайдя в тупик с обычными вооружениями, изобретет какие-то новые формы химической войны, чреватые новыми рисками для человечества.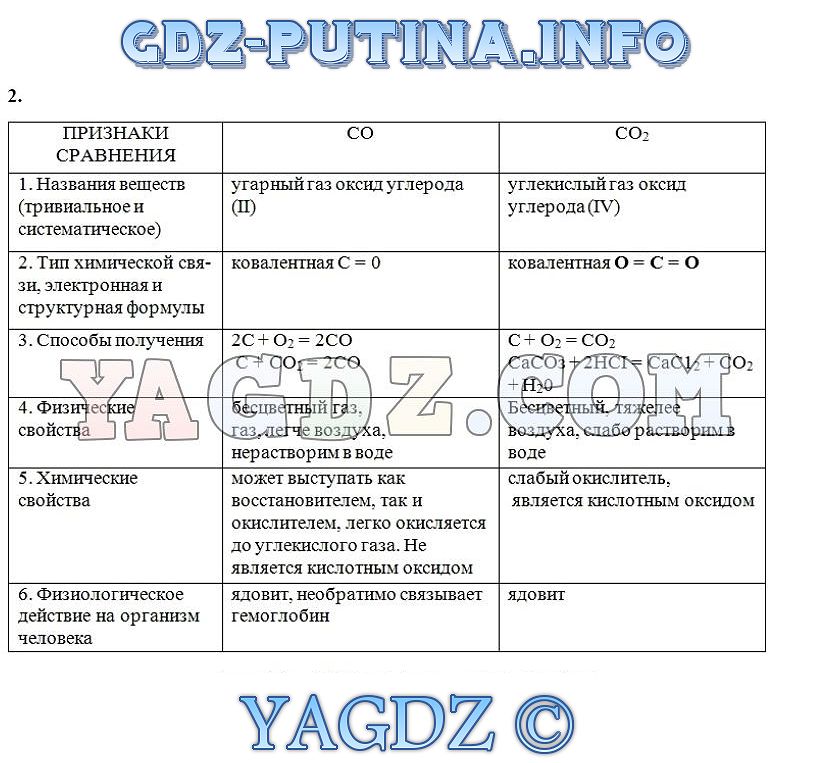


 И. Менделеева и строение их атомов. Физические свойства металлов. Сплавы
И. Менделеева и строение их атомов. Физические свойства металлов. Сплавы Водород
Водород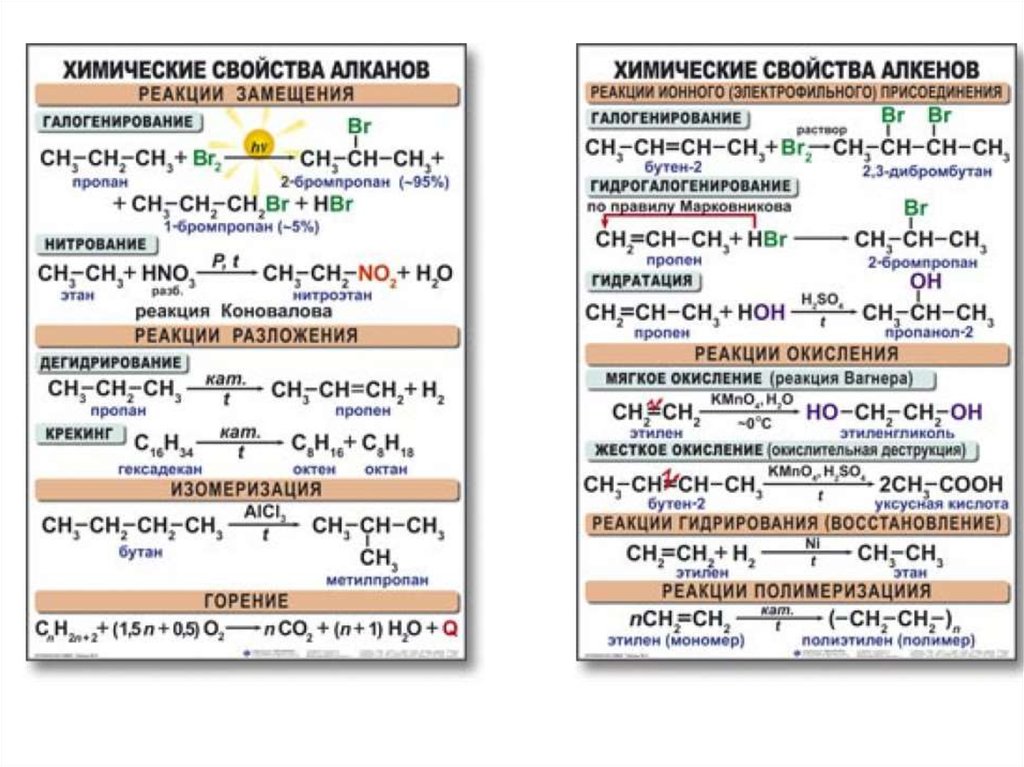 Обобщение и систематизация знаний по теме «Неметаллы»
Обобщение и систематизация знаний по теме «Неметаллы»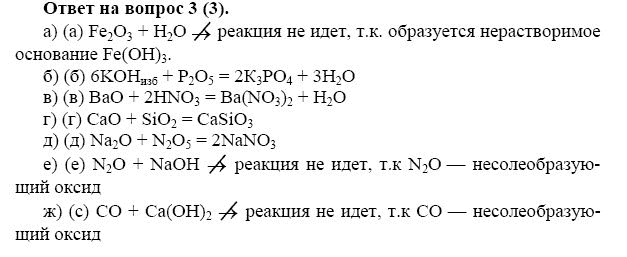 Виды химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ
Виды химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ
 Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина
Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина Д., Сизова Е.В., Давыдова С.М., Николаева А.А., Корпачева Л.Н.
Д., Сизова Е.В., Давыдова С.М., Николаева А.А., Корпачева Л.Н. Г., Семенов П.В.
Г., Семенов П.В.