Химия 9 класс — параграф 1 задание 6 Рудзитис, Фельдман, ГДЗ, решебник, онлайн
ГДЗ / Решебники / 9 класс / Химия / Рудзитис / §1 задание 6
ГДЗ(готовые домашние задания), решебник онлайн по химии за 9 класс авторов Рудзитис, Фельдман параграф 1, подумай, ответь, выполни…, задание 6 — вариант решения номера 6
§1. Окислительно-восстановительные реакции:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§2. Тепловые эффекты химических реакций:
Подумай, ответь, выполни…: 2 3 4
§3. Скорость химических реакций:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§4.
 Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость:
Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость:Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии:
Подумай, ответь, выполни…: 2 3 Тестовые задания
§6. Сущность процесса электролитической диссоциации:
Подумай, ответь, выполни…: 1 2 3 4
§7. Диссоциация кислот, оснований и солей:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§9.
 Реакции ионного обмена:
Реакции ионного обмена:Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания Лабораторный опыт
§10. Гидролиз солей:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»:
Практическая работа 2
§12. Характеристика галогенов:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§13.
 Хлор:
Хлор:Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания
§14. Хлороводород: получение и свойства:
Подумай, ответь, выполни…: 1 2 3
§15. Соляная кислота и её соли:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств:
Практическая работа 3
§17. Характеристика кислорода и серы:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания Лабораторный опыт
§18.
 Свойства и применение серы:
Свойства и применение серы:Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§19. Сероводород. Сульфиды:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота:
Подумай, ответь, выполни…: 1 2 4 Тестовые задания Лабораторный опыт
§21. Оксид серы(VI). Серная кислота:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§22.
 Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»:
Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»:Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота:
Подумай, ответь, выполни…: 1 2 3
§24. Аммиак:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств:
Практическая работа 5
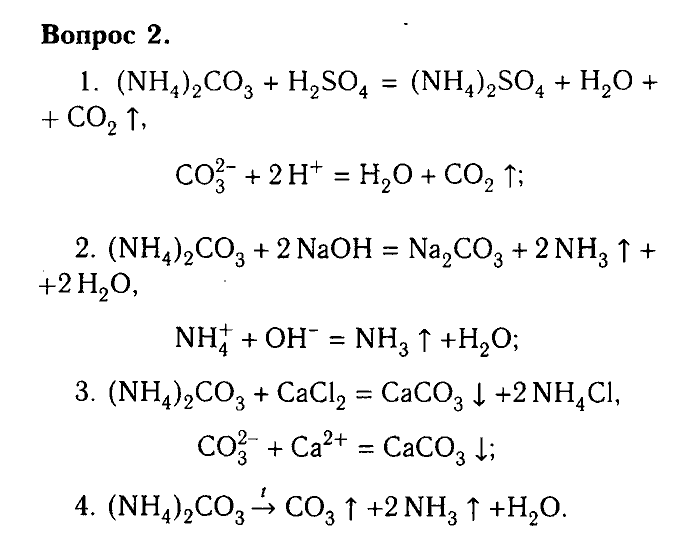
§26. Соли аммония:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§27. Азотная кислота:
Подумай, ответь, выполни. ..:
1
2
3
4
5
7
Тестовые задания
..:
1
2
3
4
5
7
Тестовые задания
§28. Соли азотной кислоты:
Подумай, ответь, выполни…: 1 2 3
§29. Фосфор:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли:
Подумай, ответь, выполни…: 1 2 3 4
§31. Характеристика углерода и кремния. Аллотропия углерода:
Подумай, ответь, выполни…: 1 2 3
§32.
 Химические свойства углерода. Адсорбция:
Химические свойства углерода. Адсорбция:Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания
§33. Оксид углерода(II) — угарный газ:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§34. Оксид углерода(IV) — углекислый газ:
Подумай, ответь, выполни…: 1 2 3 4 Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания Лабораторный опыт
§36.
 Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов:
Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов:Практическая работа 6
§37. Кремний. Оксид кремния(IV):
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент:
Подумай, ответь, выполни…: 1 2 3 4
§39. Характеристика металлов:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения:
Подумай, ответь, выполни…: 1 2 3
§41.
 Химические свойства металлов. Электрохимический ряд напряжений металлов:
Химические свойства металлов. Электрохимический ряд напряжений металлов:Подумай, ответь, выполни…: 1 2 3 Лабораторный опыт
§42. Сплавы:
Подумай, ответь, выполни…: 1 2 3
§43. Щелочные металлы:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§44. Магний. Щелочноземельные металлы:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды:
Подумай, ответь, выполни. ..:
1
2
3
4
5
Тестовые задания
Лабораторный опыт
..:
1
2
3
4
5
Тестовые задания
Лабораторный опыт
§46. Алюминий:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 8 Тестовые задания
§47. Важнейшие соединения алюминия:
Подумай, ответь, выполни…: 1 2 3 4 5 Лабораторный опыт
§48. Железо:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§49.
 Соединения железа:
Соединения железа:Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§50. Практическая работа 7. Решение экспериментальных задач по теме «Металлы»:
Практическая работа 7
§51. Органическая химия:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§52. Предельные (насыщенные) углеводороды:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды:
Подумай, ответь, выполни…: 1 2 3 4 5
§54.
 Полимеры:
Полимеры:Подумай, ответь, выполни…: 1 2
§55. Производные углеводородов. Спирты:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§57. Углеводы:
Подумай, ответь, выполни…: 1 2 3
§58. Аминокислоты. Белки:
Подумай, ответь, выполни…: 1 2 3 4 5
Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман (решебник)
Перейти к содержанию
Search for:
Авторы: Рудзитис Г. Е., Фельдман Ф.Г.
Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты.
 О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.Что делали? | Что наблюдали? | Вывод |
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2. Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке. Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту. | При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта Газ хорошо растворяется в воде и немного в с ней взаимодействует: Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится: | Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды). С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой). |
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис.
 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.Что делали? | Что наблюдали? | Вывод |
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ. | В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта: При горящей лучинке аммиак горит жёлто-зелёным пламенем: | При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства. |
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси.
 Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?Что делали? | Что наблюдали? | Вывод |
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты. | Наблюдается появление белого дыма, характерного для соли аммония: | При взаимодействии аммиака с концентрированными кислотами образуются соли аммония. |
4. Отчёт о работе оформите в виде таблицы (см. § 16).
Таблица представлена выше (пункты 1,2,3).
Выберите параграф
12345678910111213141516171819202122232425262728293031323334353637383940414243444546474849505152535455565758
AP Химия – Студенты AP
Не студент?
Посетите AP Central, чтобы получить ресурсы для учителей, администраторов и координаторов.
AP Химия
Перейти к моей точке доступа
О курсе
Узнайте об основных понятиях химии, включая структуру и состояние вещества, межмолекулярные силы и реакции. Вы будете проводить практические лабораторные исследования и использовать химические расчеты для решения проблем.
Примечание: Сохраняйте лабораторные журналы и отчеты; колледжи могут попросить вас увидеть их, прежде чем предоставить вам кредит.
Навыки, которым вы научитесь
Эквивалентность и предварительные условия
Эквивалент курса колледжа
Годовой вводный курс общей химии в колледже
Рекомендуемые предварительные требования
Курсы химии и алгебры для старших классов средней школы 8 Экзамен 105 II 90 90 Датировать
О модулях
Содержание курса, описанное ниже, организовано в виде общеизучаемых учебных модулей, которые предоставить одну возможную последовательность для курса. Ваш преподаватель может решить организовать курс контента по-разному в зависимости от местных приоритетов и предпочтений.
Содержание курса
Блок 1: Атомная структура и свойства
Вы узнаете о составе атомов и о том, как ученые измеряют и классифицируют эти молекулярные строительные блоки.
Темы могут включать:
- Моль и молярная масса
- Масс-спектроскопия элементов
- Элементный состав чистых веществ
- Состав смесей
- Атомная структура и электронная конфигурация
- Фотоэлектронная спектроскопия
- Периодические тренды
- Валентные электроны и ионные соединения
7–9% от экзаменационного балла
Модуль 2: Молекулярная и ионная структура и свойства соединений
Вы узнаете о множестве химических связей и о том, как их структура может влиять на свойства создаваемых молекул.
Темы могут включать:
- Типы химической связи
- Внутримолекулярная сила и потенциальная энергия
- Структура ионных твердых тел
- Структура металлов и сплавов
- Диаграммы Льюиса
- Резонанс и официальное обвинение
- ВСЕПР и гибридизация связи
7–9% от экзаменационного балла
Блок 3: Межмолекулярные силы и свойства
Вы узнаете, как атомы собираются вместе, чтобы создавать твердые тела, жидкости и газы, и как субатомные силы управляют свойствами всего вокруг вас.
Темы могут включать:
- Межмолекулярные силы
- Твердые вещества, жидкости и газы
- Кинетическая молекулярная теория
- Растворы и смеси
- Фотоэлектрический эффект
18–22% от экзаменационного балла
Раздел 4: Химические реакции
Вы научитесь различать физические и химические процессы, а также измерять и выражать химические реакции с помощью химических уравнений.
Темы могут включать:
- Введение для реакций
- Сводные ионные уравнения
- Представления реакций
- Физические и химические изменения
- Стехиометрия
- Типы химических реакций
7–9% от экзаменационного балла
Раздел 5: Кинетика
Вы изучите различные методы наблюдения за изменениями, происходящими во время химической реакции, и последствиями ряда реакций.
Темы могут включать:
- Скорость реакции
- Введение в закон о тарифах
- Элементарные реакции
- Модель столкновения
- Введение в механизмы реакции
- Энергетический профиль многоступенчатой реакции
- Катализ
7–9% от экзаменационного балла
Раздел 6: Термодинамика
Вы узнаете об изменениях энергии в химических реакциях и о том, как передача энергии может изменить физические свойства вещества.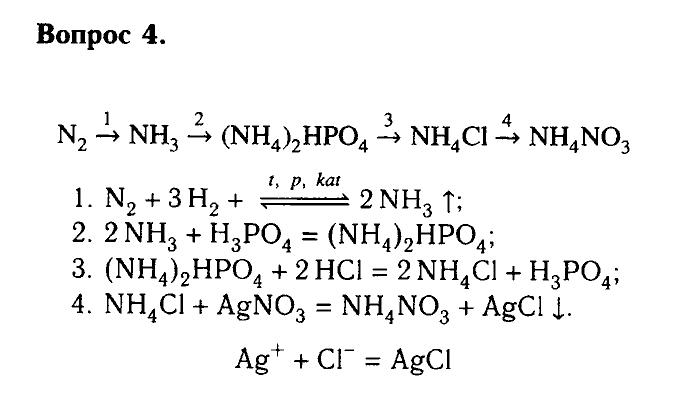
Темы могут включать:
- Эндотермические и экзотермические процессы
- Теплопередача и тепловое равновесие
- Теплоемкость и калориметрия
- Энергия фазовых переходов
- Введение в энтальпию реакции
- Энтальпия образования
- Закон Гесса
7–9% от экзаменационного балла
Раздел 7: Равновесие
Вы наметите, как химические реакции меняются с течением времени, что заставляет вещества достигать равновесия и как системы реагируют, когда это равновесие нарушается.
Темы могут включать:
- Введение в равновесие
- Расчет константы равновесия
- Расчет равновесных концентраций
- Введение в принцип Ле Шателье
- Введение в равновесие растворимости
- рН и растворимость
- Свободная энергия растворения
7–9% от экзаменационного балла
Раздел 8: Кислоты и основания
Вы узнаете больше о рН, качествах и свойствах кислот и оснований, а также о том, как они взаимодействуют в химических реакциях.



