Химия. 9 класс. Учебник Габриелян О.С,, Остроумов И.Г., Сладков С.А.
- Главная /
- Каталог /
- Основное образование (5-9 классы) /
- Химия /
-
Химия.

Линия УМК: Химия. Габриелян О.С. (8-9)
Серия: Нет
Автор: Габриелян О.С,, Остроумов И.Г., Сладков С.А.
Номер ФПУ : 1.1.2.5.3.1.2
863,00 ₽
Количество:
Аннотация
Завершённая предметная линия УМК О.С.Габриеляна по химии разработана в соответствии с требованиями ФГОС основного общего образования. Учебники линии включены в Федеральный перечень и рекомендованны к использованию в общеобразовательных организациях. Содержание курса выстроено в соответствии с историко-логическим и системно-деятельностным подходами на основе иерархии учебных проблем.

| Артикул | 20-0280-03 |
| ISBN | 978-5-09-101375-7 |
| Год титула | 2022 |
| Размеры, мм | 200x280x15 |
| Количество страниц | 224 |
| Красочность | цветная |
| Вес, кг | 0,4800 |
| Класс/Возраст |
9 кл. |
| Предмет | Химия |
| Издательство | Просвещение |
Оставьте отзыв первым
Контрольная работа по химии 9 класс «Неметаллы»
Тема урока: Контрольная работа по теме: «Неметаллы»
Цель урока: определение уровня знаний, сформированности и навыков, комплексного их применения. Закрепление и систематизация знаний по теме «Неметаллы».
Задачи:
Образовательные: проверить знания, умения и навыки учащихся, сформированные при изучении темы «Неметаллы».
Развивающие: развивать навык самостоятельности; химический язык, вычислительные навыки; логическое мышление, память, внимание, развивать умение самоконтроля и самопроверки.
Воспитательные: воспитывать интерес к химии, аккуратность, желание выполнить работу на хорошо и отлично.
Тип урока: урок контроля умений и навыков.
Оборудование:
Ход урока:
Организационный момент.
Сообщение темы урока: Контрольная работа по теме: «Неметаллы»
Знакомство с текстом контрольной работы.
Работа в тетрадях. Оформление тетради (число, месяц)
Контрольная работа по теме: «Неметаллы» 9 класс
Вариант 1
1. Запишите электронную формулу химического элемента с порядковым номером 15.
2. Определите, в каких реакциях N является окислителем, а в каких восстановителем:
а) при взаимодействии с металлом;
б) при взаимодействии с водородом;
в) при взаимодействии с кислородом.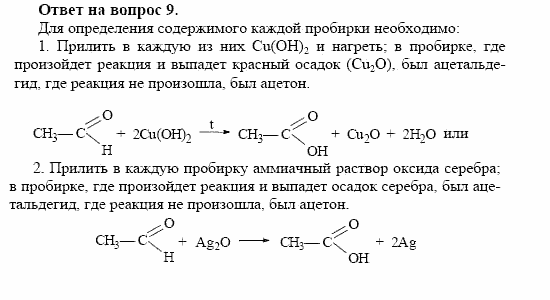
(запишите эти реакции!)
3. Осуществить цепочку превращений. Si→Mg
2Si→SiO2→Na2SiO3→H2SiO3→SiO24. Предположите план распознавания растворов: сульфата, хлорида и иодида натрия.
Запишите уравнения использованных реакций.
5. Вычислите массу осадка, выпавшего при сливании 104 мг 20%-го раствора хлорида бария с избытком раствора серной кислоты.
Контрольная работа по теме: «Неметаллы» 9 класс
Вариант 2
1. Запишите электронную формулу химического элемента с порядковым номером 16.
2. Определите, в каких реакциях Р является окислителем, а в каких восстановителем:
а) при взаимодействии с металлом;
б) при взаимодействии с водородом;
в) при взаимодействии с кислородом.
(запишите эти реакции!)
3. Осуществить цепочку превращений. S → ZnS → SO2 →SO3 → H2SO4 → BaSO4
4. Предположите план распознавания растворов: соляной, серной, азотной кислот. Запишите уравнения использованных реакций.
5. Какой объем аммиака можно получить при взаимодействии 10,7 кг хлорида аммония с гидроксидом кальция, если доля выхода продукта 98%?
Контрольная работа по теме: «Неметаллы» 9 класс
Вариант 3
1. Запишите электронную формулу химического элемента с порядковым номером 17.
2. Определите, в каких реакциях S является окислителем, а в каких восстановителем:
а) при взаимодействии с металлом;
б) при взаимодействии с водородом;
в) при взаимодействии с кислородом.
(запишите эти реакции!)
3. Осуществить цепочку превращений. NH3→NO→NO2→HNO3→Cu(NO3)2→CuO
4. Предположите план распознавания растворов: фосфата, карбоната и гидроксида натрия. Запишите уравнения использованных реакций.
5. К раствору, в котором находится 42,6 грамм нитрата алюминия, прилили раствор, содержащий 16 килограмм гидроксида натрия. Рассчитайте массу образовавшегося осадка.
ПРИЛОЖЕНИЕ
1.
2. а) 6Li + N2 = 2Li3N (ок-ль)
б) 3h3 + N2=2Nh4 (ок-ль)
в) N2 + O2=2NO (вост-ль)
3 .Si→Mg2Si→SiO2→Na2SiO3→H2SiO3→SiO2
1) Si +2 MgO = Mg2Si + O2
2) Mg2Si + 2O2 = 2MgO + SiO2
3) 2NaOH+SiO2=Na2SiO3+h3O (Na2CO3+SiO2=Na2SiO3+CO2)
4) Na2SiO3 + 2HCl = 2NaCl + h3SiO3
5) h3SiO3 = SiO2 + h3O
4. в пробирки капаем р-р BaCl2 и в пробирке с Na2SO4 образуется осадок белого цвета, в двух других изменений нет
в пробирки капаем р-р BaCl2 и в пробирке с Na2SO4 образуется осадок белого цвета, в двух других изменений нет
Na2SO4+BaCl2=BaSO4↓+ 2NaCl
Качественная реакция на хлорид-ион – реакция с нитратом серебра AgNO3. Белый осадок хлорида серебра выпадает в той пробирке, где находится хлорид натрия.
NaCl + AgNO3= AgCl↓ + NaNO3
прилить раствор AgNO3 там, где был иодид, выпадет желтый осадок желтого цвета
AgNO3 + NaI = AgI↓ + NaNO3
5.
Дано: | СИ | Решение: |
m(BaCl2)=104мг w(BaCl2)=20% | 0,104 г 0,2 | h3SO4+BaCl2 BaSO4 +2HCl m в-ва(BaCl2) = w(BaCl2)*m р-ра(BaCl2) = 0,2*0,104=0,0208 г m(BaCl2)= 1моль*208 г/моль=208 г m(BaSO4)=233г HSO4 в избытке расчет по недостатку M (BaCl2) = 208г/моль 0,0208/ 208= x/233 X=0,0208*233/208=0,0233 |
m(BaSO4)-? |
Ответ: m(BaSO4)=0,0233г=233 мг
Вариант 2
1.
2.а) 3Li + P = Li3P (ок-ль)
б) 3h3 + 2P=2Ph4 (ок-ль)
в) 4P +5O2 = 2P2O5 (вост-ль)
3.S → ZnS → SO2 →SO3 → H2SO4 → BaSO4
1)S+Zn= ZnS
2) 2ZnS+3O2 = ZnО+ 2SO2
3) 2SO2+ O2 = 2SO3 (SO2+ NaSO3 = SO3 + NaSO2 )
4)SO3+h3O= h3SO4
5)h3SO4 + BaCL2 = BaSO4 + 2HCL
4. Серную кислоту определим по сульфат-иону. Качественная реакция на сульфат-ион – реакция с хлоридом бария.
H2SO4+ BaCl2 = BaSO4↓ + 2HCl (осадок белого цвета)
Во второй пробирке выпадает осадок сульфата бария, значит в колбе номер два – серная кислота. Соляную кислоту можно определить по иону хлора качественной реакцией с нитратом серебра.
HCl + AgNO3 = AgCl↓ + HNO3 (белый осадок)
В пробирке с соляной кислотой выпадает белый осадок хлорида серебра. В колбе номер один – соляная кислота. Остается убедиться в том, что в последней пробе – азотная кислота. Опустим в пробирку кусочек меди и нагреем раствор. Образуется голубой раствор нитрата меди и выделяется бурый газ – диоксид азота.
4HNO3 + Cu = Cu(NO3)2 + 2NO2↑ +2H2O
5.
Дано: | СИ | Решение: |
m(Nh5CL)=10,7кг wвых.(практ.)=298% | 10700 г 0,98 | 2Nh5CL+Ca(OH)2=2Nh4+CaCl2+2h3O M(Nh5Cl)=53,5 г/моль m(Nh5Cl)= n*M=2*53,5=107 г n=m/M=10700/53,5=200 моль n=v/vm v=n*vm=2*22,4=44,8 10700г/107г=x л/44,8л х теор. w=m пр/m теор=v пр/v теор v пр=v теор*w=0,98*44880=4390,4 л или 4480л=100% х л=98% х=4390,4 л |
v(Nh4)-? |
Ответ: v(Nh4)=4390,4 л
Вариант 3
1.
2.а) 2Li+S=Li2S (ок-ль)
б) Н2 + S = h3S (t) (ок-ль)
в) O2 + S = SO2 (вост-ль)
3.NH3→NO→NO2→HNO3→Cu(NO3)2→CuO
4Nh4 +5O2 =4NO+6h3O
2NO+O2 =2NO2
4NO2 +2h3O+O2 =4HNO3
2HNO3 +Cu(OH)2 =Cu(NO3)2 +2h3O
2Cu(NO3)2 = 2CuO +4NO2 +O2
4.Для карбоната:Na2CO3 +AgNO3 = Ag2CO3 (бледно-желтый осадок) + 2NaNO3
Для фосфата:Na3PO4 +3LiNO3 = 3NaNO3 + LiPO4 (белый осадок)
Для гидроксида:2NaOH+CuSO4 = Cu(OH)2 (синий осадок) + NaSO4
5.



 = 4480 л
= 4480 л