Химический практикум – разработки уроков по химии – Корпорация Российский учебник (издательство Дрофа – Вентана)
Автор: Лаптева Евгения Павловна, учитель химии МАОУ «Лицей №4» муниципального образования города Чебоксары, Чувашская Республика
Пояснительная записка
Программа курса по выбору предназначается для учащихся 9 класса и рассчитана на 34 часа в год, 1ч в неделю.
Рабочая программа составлена на основании:
- Федерального закона от 29.12.12г. №273 Ф.З. «Об образовании в Российской Федерации»;
- Федерального компонента государственного стандарта основного общего образования;
- Программы Министерства образования Российской Федерации от 30.08.13г. №1015 «Об утверждении Порядка организации и осуществлении образовательной деятельности по основным общеобразовательным программам основного общего образования»;
- Примерной программы для общеобразовательных учреждений.
 Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008.
Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008.
Целью данного курса является: помочь ученикам сориентироваться в химико-биологическом профиле и прививать практические навыки работы в химической лаборатории.
Данный курс не дублирует школьную программу, а способствует формированию умений и навыков практической работы, развивает способности учащихся и укрепляет их желание посвятить себя работе по химической специальности.
Учащиеся экспериментальным путем знакомятся с составом веществ и их химическими свойствами, приобретают определенные умения и навыки выполнения различных химических операций (смешивание, измельчение, растворение веществ, нагревание, фильтрование, титрование и т.д.), причем все выполняют своими руками, что укрепляет их интерес к предмету.
Большое значение для развития интереса учащихся к химии, которая является, прежде всего, экспериментальной наукой, имеют самостоятельные практические работы учащихся.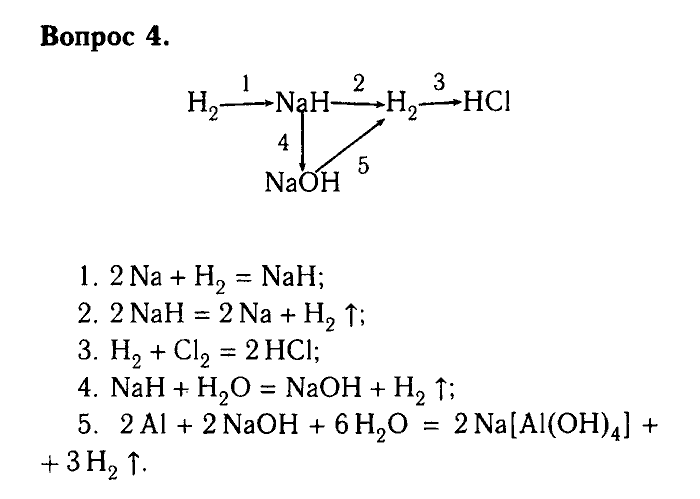
Для приобретения практических навыков и повышения уровня знаний предусматривается выполнение проектной работы и итоговой контрольной работы, практических (15 уроков) работ. Рабочая программа для 9 класса предусматривает обучение химии 1 часа в неделю (34 часа в год) из них 2 резервных часа.
В рамках данной программы использованы две формы обучения: лекционно-семинарские и практические работы.
При формировании понятий курса следует учитывать, что учащиеся затрагивают межпредметную связь. Например: природоведение, биологию, географию, трудовое обучение, физику. Поэтому, в конце курса предусмотрено выполнение проектных работ с использованием местного материала, например: исследование качества водопроводной воды, или, определение загрязнителей в снежном покрове и т.д.
После изучения курса учащиеся должны уметь характеризовать свойства веществ на основе теоретических представлений, зависимость получений и применения веществ от их внутренней структуры, а также правильное обращение с химической посудой и реактивами.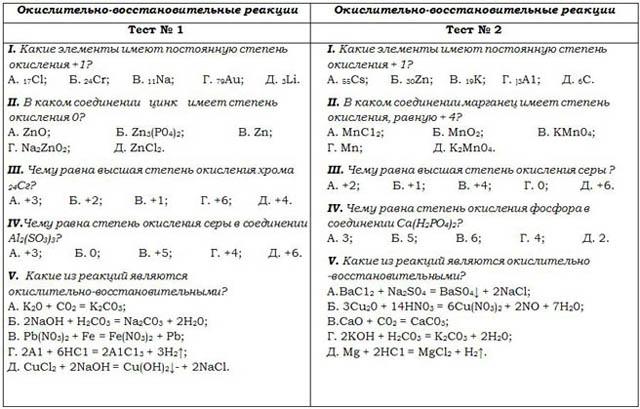
Результаты обучения оцениваются по зачетной системе при выполнении ими химического эксперимента, где рассматривается глубина, осознанность, полнота выполняемого эксперимента.
Курс может быть оценен положительно, если ученик:
- проделал 90 % практических работ;
- выполнил итоговую контрольную работу не менее 60%;
- активно участвовал в работе.
Формы контроля ЗУН:
- беседа (на каждом уроке для формирования умения учащихся грамотно говорить, используя хим. термины и понятия) + индивидуальный опрос;
- письменный тестовый зачет по каждой теме;
- зашита проектных работ;
Форма промежуточной аттестации: итоговая контрольная работа.
Содержание разделов учебного предмета
(34 часа, 1 час в неделю)
Раздел 1. Введение. (3 часа)
Тема 1.1. Место химии среди естественных наук. (1 час)
(1 час)
Инструктаж по ТБ. Первая помощь при ожогах, отравлениях, порезах.
Тема 1.2. Практическая работа (2 часа)
ПР № 1. Знакомство с лабораторным оборудованием. Правила ТБ в лаборатории.
ПР №2. Чистые вещества и смеси. Методы разделения смесей.
Раздел 2. Основы химического анализа. (12 часов)
Тема 2.1. Ионы. (5 часов)
Классификация катионов по кислотно-щелочной схеме анализа.
Тема 2.2. Анализ различных объектов. (5 часов)
Определение качества воды. Определение нитратов, катионов тяжелых металлов.
Тема 2.3. Выход продукта реакции. (2 часа)
Решение задач на определение выхода продукта реакции.
ПР№3-9
Раздел 3. Неметаллы и их соединения. (7 часов)
Тема 3.1. Азот и его соединения. (1час)
ПР№10Азот, аммиак, соли аммония. Определение солей аммония.
Тема 3.2. Водород и его свойства.(3 часа)
Окислительно-восстановительные свойства водорода. Получение мыльных пузырей.
Тема 3.2. Решение экспериментальных задач.(3 часа)
ПР№10-13
Раздел 4. Общие свойства металлов. (7 часов)
Тема 7.1. Окислительные свойства соединений металлов.( 3 часа)
Окислительные свойства бихромата и перманганата калия.
Тема 7.2. Амфотерность.(4часа)
Амфотерные оксиды и гидроксиды. Получение и свойства.
ПР№14-15
Раздел 5. Определение предметных компетентностей. (3 часа)Тема 5.1. Решение экспериментальных задач.
Итоговая контрольная работа.
Резерв (2ч)
Требования к уровню подготовки учащихся
В результате изучения химии в 9 классе ученик должен знать/ понимать:
- Хим.
 символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций;
символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций; - Важнейшие хим.понятия: хим.элемент, атом, молекула, относительные атомная и молекулярная массы, ион, хим. Связь, вещество, классификация веществ, моль, молярная масса, молярный объем, хим.реакция, классификация реакций, степень окисления, валентность, окислитель и восстановитель, окисление и восстановление, электорлит и неэлектролит, электролитическая диссоциация;
- Основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
Уметь:
- Называть хим. элементы, соединения изученных классов;
- Объяснять физический смысл атомного (порядкового) номера хим.элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе элементов Д.И.Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
- Характеризовать хим.
 элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ;
элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ; - Определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы хим.реакций, валентность и степень окисления, вид хим.связи в соединениях, возможность протекания реакций ионного обмена;
- Составлять: формулы неорганических соединений; схемы строения атомов первых 20 элементов периодической системы элементов Д.И.Менделеева; уравнения хим.реакций;
- Обращаться с хим. посудой и лабораторным оборудованием;
- Распознавать: опытным путем кислород, водород, растворы кислот и щелочей, хлорид-, сульфат-, карбонат — ионы;
- Вычислять: массовую долю хим.элемента в веществе, массовую долю вещества в растворе, количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни с целью:
- Безопасного обращения с веществами и материалами;
- Экологически грамотного поведения в окружающей среде;
- Оценки влияния хим.

- Критической оценки информации о веществах, используемых в быту;
- Приготовления растворов заданной концентрации.
Календарно-тематическое планирование
|
№ |
Сроки (месяц) |
Тема урока |
Тип урока с указанием лабораторных, практических, контрольных работ |
Вид и форма контроля за уровнем усвоенного |
НРК |
| Введение (3 ч) | |||||
|
1 |
Сентябрь |
Место химии среди естественных наук. |
Урок повторения и обобщения |
|
|
|
2 |
|
ПР № 1. Знакомство с лабораторным оборудованием. Правила ТБ при работе в хим. лаборатории. |
Урок применения знаний и умений |
Практическая работа |
|
|
3 |
Сентябрь |
ПР №2. |
Урок применения знаний и умений |
Практическая работа |
|
|
Основы химического анализа (12 ч) |
|||||
|
4. |
Сентябрь |
Ионы. Классификация катионов по кислотно-щелочной схеме анализа. |
Урок ознакомления с новым материалом |
|
|
|
5. |
октябрь |
ПР № 3. Катионы и опыты с ними. |
Урок применения знаний и умений |
Практическая работа |
|
|
6. |
октябрь |
ПР№4. Качественный анализ на катионы. |
Урок применения знаний и умений |
Практическая работа |
|
|
7. |
октябрь |
Использование реакций осаждения в качественном анализе. Групповые, селективные реакции анионов. |
Урок ознакомления с новым материалом |
|
|
|
8. |
октябрь |
ПР№5. Групповые, селективные реакции анионов. |
Урок применения знаний и умений |
Практическая работа |
|
|
9. |
октябрь |
Анализ реальных объектов: «Сухая задача». |
Урок ознакомления с новым материалом |
|
|
|
10. |
Ноябрь |
ПР№6.Анализ вещества или смеси двух веществ. |
Урок применения знаний и умений |
Практическая работа |
|
|
11. |
Ноябрь |
Определение качества воды. |
Урок ознакомления с новым материалом |
|
ОАО «Водоканал» |
|
12. |
Ноябрь |
ПР№7.Определение нитратов и нитритов, катионов тяжелых металлов в воде. |
Урок применения знаний и умений |
Практическая работа |
|
|
13. |
Декабрь |
ПР№8.Капельный анализ с полуколичественным определением ионов железа в природной воде. |
Урок применения знаний и умений |
Практическая работа |
|
|
14. |
Декабрь |
ПР№9.Определение выхода продукта реакции. |
Урок применения знаний и умений |
Практическая работа |
|
|
15. |
Декабрь |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
|
|
Неметаллы и их соединения (7 ч) |
|||||
|
16. |
Декабрь |
ПР№10.Азот, аммиак, соли аммония. Определение солей аммония. |
Урок применения знаний и умений |
Практическая работа |
|
|
17-18. |
Январь |
Окислительно-восстановительная двойственность водорода. |
Урок ознакомления с новым материалом |
|
|
|
19. |
Январь |
ПР№ 11. Водород как окислитель и восстановитель. |
Урок применения знаний и умений |
Практическая работа |
|
|
20. |
Февраль |
Решение экспериментальных задач по по теме «Подгруппа кислорода» |
Урок ознакомления с новым материалом |
|
|
|
21. |
Февраль |
Решение экспериментальных задач по по теме «Подгруппа углерода» |
Урок применения знаний и умений |
Практическая работа |
|
|
22. |
Февраль |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
|
|
Общие свойства металлов (7ч) |
|||||
|
23, 24 |
Февраль ,Март |
Изучение ОВР процессов на примере перманганата и бихромата калия. |
Урок ознакомления с новым материалом |
|
|
|
25. |
Март |
ПР№14. Опыты с перманганатом калия. |
Урок применения знаний и умений |
Практическая работа |
|
|
26,27 |
март |
Изучение свойств амфотерных соединений. |
Урок ознакомления с новым материалом |
|
|
|
28. |
Апрель |
ПР№ 15.Получение амфотерного гидроксида и изучение его свойств. |
Урок применения знаний и умений |
Практическая работа |
|
|
29. |
Апрель |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
|
|
Определение предметных компетентностей (3 ч) |
|||||
|
30. |
Апрель |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
На основе региональных данных |
|
31. |
Май |
Решение экспериментальных задач. |
Урок применения знаний и умений |
Практическая работа |
На основе региональных данных |
|
32. |
Май |
Итоговая контрольная работа. |
Урок применения знаний и умений |
|
|
|
Резерв (2 ч) |
|||||
|
33. |
Май |
Обобщение и повторение. |
|
|
|
|
34. |
май |
Обобщение и повторение. |
|
|
|
ГДЗ практическая работа 6 химия 9 класс Габриелян – Telegraph
>>> ПОДРОБНЕЕ ЖМИТЕ ЗДЕСЬ <<<
ГДЗ практическая работа 6 химия 9 класс Габриелян
ГДЗ : готовые ответы по химии за 9 класс , решебник Габриелян О .С ., онлайн решения на GDZ .RU .
Практическая работа №6 Вариант 1 . Опыт 1 . 1 . В пробирку положили 1-2 гранулы цинка и добавили в нее 1-2мл соляной кислоты . Наблюдается выделение водорода (гремучий газ), так как при поднесении горлышка пробирки к горящей спиртовке раздается лающий звук .
ГДЗ (готовые домашние задания ), решебник онлайн по химии за 9 класс авторов Габриелян , Лысова практическая работа 6 — вариант решения практической работы 6 .
Подробный решебник (ГДЗ ) по Химии за 9 (девятый ) класс — готовый ответ практическая работа — 6 . Авторы учебника: Габриелян . Издательство: Дрофа , 2020 .
Ответы к заданиям по химии за 9 класс к учебнику Габриеляна . ГДЗ 9 класс Химия Габриелян О .С . Практическая работа №4; Практическая работа №5; Практическая работа №6
9 класс . Габриелян 2019 . ГДЗ и решебник к учебнику по химии 9 класса О . С . Габриеляна 2019 .
Гдз контрольные и самостоятельные работы к уч . Габриеляна по Химии за 9 класс можно найти тут .
Решебник по химии за 9 класс авторы Габриелян издательство Дрофа Задание: Вариант 1 . ГДЗ химия 9 класс Габриелян Дрофа .
ГДЗ и решебник по химии 9 класс Габриелян . Молярная масса азота равна 10 а . о . м . Погодите-ка, или 12? Может, 14? Этот решебник содержит ответы на все задания учебника и пояснительные комментарии к большинству задачек .
Вы открыли задание №6 из решебника на uchim .org . Другие номера: ГДЗ по химии 9 класс Габриелян .
ГДЗ к контрольным и самостоятельным работам по химия за 9 класс Павлова Н .С . можно скачать здесь . ГДЗ к тетради для оценки качества знаний по химии за 9 класс Габриелян О .С . Купцова А .В . можно скачать здесь .
Решебники и ГДЗ . Классы . Практическая работа № 6 (н) . Получение, собирание и распознавание газов . Источник: Решебник по химии за 9 класс (О .С .Габриелян , год), задача №6 к главе «Практические работы» .
Готовое домашние задание (ГДЗ , решебники), ответы онлайн по Химии за 9 класс : учебник / О . С . Габриелян . предложение нескольких вариантов решения по каждому заданию . Обратившись к решениям нашего сайта, девятиклассники смогут уяснить схему решения задач . .
Другие решебники по химии для 9 классa . Габриелян О .С, Березкин П .Н . Габриелян О .С . Березкин П .Н ., -М .: Дрофа, .
Главная Готовые домашние задания . Главная ГДЗ 9 класс Химия Габриелян — Учебник . К девятому классу большинство школьников уже сориентированы на поступление в Работа над этой наукой подразумевает усидчивость, знание теории и умение проводить элементарные . .
К девятому классу большинство школьников уже сориентированы на поступление в Работа над этой наукой подразумевает усидчивость, знание теории и умение проводить элементарные . .
ГДЗ : готовые ответы по химии за 9 класс , решебник Габриелян О .С ., онлайн решения на GDZ .RU .
Практическая работа №6 Вариант 1 . Опыт 1 . 1 . В пробирку положили 1-2 гранулы цинка и добавили в нее 1-2мл соляной кислоты . Наблюдается выделение водорода (гремучий газ), так как при поднесении горлышка пробирки к горящей спиртовке раздается лающий звук .
ГДЗ (готовые домашние задания ), решебник онлайн по химии за 9 класс авторов Габриелян , Лысова практическая работа 6 — вариант решения практической работы 6 .
Подробный решебник (ГДЗ ) по Химии за 9 (девятый ) класс — готовый ответ практическая работа — 6 . Авторы учебника: Габриелян . Издательство: Дрофа , 2020 .
Ответы к заданиям по химии за 9 класс к учебнику Габриеляна . ГДЗ 9 класс Химия Габриелян О .С . Практическая работа №4; Практическая работа №5; Практическая работа №6
9 класс . Габриелян 2019 . ГДЗ и решебник к учебнику по химии 9 класса О . С . Габриеляна 2019 .
Габриелян 2019 . ГДЗ и решебник к учебнику по химии 9 класса О . С . Габриеляна 2019 .
Гдз контрольные и самостоятельные работы к уч . Габриеляна по Химии за 9 класс можно найти тут .
Решебник по химии за 9 класс авторы Габриелян издательство Дрофа Задание: Вариант 1 . ГДЗ химия 9 класс Габриелян Дрофа .
ГДЗ и решебник по химии 9 класс Габриелян . Молярная масса азота равна 10 а . о . м . Погодите-ка, или 12? Может, 14? Этот решебник содержит ответы на все задания учебника и пояснительные комментарии к большинству задачек .
Вы открыли задание №6 из решебника на uchim .org . Другие номера: ГДЗ по химии 9 класс Габриелян .
ГДЗ к контрольным и самостоятельным работам по химия за 9 класс Павлова Н .С . можно скачать здесь . ГДЗ к тетради для оценки качества знаний по химии за 9 класс Габриелян О .С . Купцова А .В . можно скачать здесь .
Решебники и ГДЗ . Классы . Практическая работа № 6 (н) . Получение, собирание и распознавание газов . Источник: Решебник по химии за 9 класс (О . С .Габриелян , год), задача №6 к главе «Практические работы» .
С .Габриелян , год), задача №6 к главе «Практические работы» .
Готовое домашние задание (ГДЗ , решебники), ответы онлайн по Химии за 9 класс : учебник / О . С . Габриелян . предложение нескольких вариантов решения по каждому заданию . Обратившись к решениям нашего сайта, девятиклассники смогут уяснить схему решения задач . .
Другие решебники по химии для 9 классa . Габриелян О .С, Березкин П .Н . Габриелян О .С . Березкин П .Н ., -М .: Дрофа, .
Главная Готовые домашние задания . Главная ГДЗ 9 класс Химия Габриелян — Учебник . К девятому классу большинство школьников уже сориентированы на поступление в Работа над этой наукой подразумевает усидчивость, знание теории и умение проводить элементарные . .
ГДЗ упражнение 300 русский язык 5 класс Практика Купалова, Еремеева
ГДЗ часть 1. страница 44 математика 5 класс Козлова, Рубин
ГДЗ учебник 2019 / часть 2. упражнение 674 (1563) математика 6 класс Виленкин, Жохов
ГДЗ страница 221 английский язык 6 класс Счастливый английский Кауфман, Кауфман
ГДЗ номер 384 алгебра 9 класс Никольский, Потапов
ГДЗ учебник 2019 / часть 2. упражнение 689 (1578) математика 6 класс Виленкин, Жохов
упражнение 689 (1578) математика 6 класс Виленкин, Жохов
ГДЗ упражнение 597 математика 5 класс Муравин, Муравина
ГДЗ итоговое повторение (А.Н. Тихонова) / Квадратные уравнения 9 алгебра 8 класс дидактические материалы Жохов, Макарычев
ГДЗ упражнение 228 математика 6 класс Истомина
ГДЗ упражнение 419 русский язык 8 класс Бархударов, Крючков
ГДЗ тетрадь 2 344 математика 5 класс рабочая тетрадь Лебединцева, Беленкова
ГДЗ часть 1. страница 134 русский язык 2 класс Желтовская, Калинина
ГДЗ упражнение 894 алгебра 10 класс Колягин, Ткачева
ГДЗ номер 72 геометрия 8 класс Мерзляк, Полонский
ГДЗ задание 6 русский язык 6 класс рабочая тетрадь Бабайцева, Сергиенко
ГДЗ номер 315 алгебра 8 класс Макарычев, Миндюк
ГДЗ упражнение 209 алгебра 7 класс Дорофеев, Суворова
ГДЗ номер 909 физика 7‐9 класс Сборник задач Перышкин
ГДЗ самостоятельные работы / С-4 / вариант 3 4 алгебра 8 класс дидактические материалы Потапов
ГДЗ по истории за 7 класс, решебник и ответы онлайн
ГДЗ §4 4. 26 алгебра 7 класс задачник Мордкович
26 алгебра 7 класс задачник Мордкович
ГДЗ глава 2 2.3 химия 8‐11 класс сборник задач и упражнений Хомченко
ГДЗ алгебра / контрольная работа / К-4 А1 алгебра 8 класс самостоятельные и контрольные работы, геометрия Ершова, Голобородько
ГДЗ упражнение 381 русский язык 7 класс Разумовская, Львова
ГДЗ самостоятельная работа / С-14 / вариант 4 2 алгебра 7 класс дидактические материалы Потапов, Шевкин
ГДЗ параграф 8 8.16 алгебра 8 класс рабочая тетрадь Зубарева, Мильштейн
ГДЗ упражнение 604 русский язык 5 класс Бунеев, Бунеева
ГДЗ страница 34 информатика 4 класс тетрадь для самостоятельной работы Бененсон, Паутова
ГДЗ часть 1 / номер 331 математика 5 класс задачник Бунимович
ГДЗ часть 2. страница 121 русский язык 3 класс Зеленина, Хохлова
ГДЗ упражнение 361 русский язык 6 класс Разумовская, Львова
ГДЗ номер 50 алгебра 9 класс Алимов, Колягин
ГДЗ страница 44 биология 10‐11 класс тетрадь-тренажер Сухорукова, Кучменко
ГДЗ вычислительный практикум 864 математика 6 класс Муравин, Муравина
ГДЗ вправа 737 алгебра 7 класс Тарасенкова, Богатырева
ГДЗ страница 146 английский язык 4 класс Карпюк
ГДЗ глава 6 14 русский язык 6 класс Шмелев, Флоренская
ГДЗ задание 104 алгебра 7 класс рабочая тетрадь Потапов, Шевкин
ГДЗ тетрадь №2. страница 39 русский язык 3 класс рабочая тетрадь Желтовская, Калинина
страница 39 русский язык 3 класс рабочая тетрадь Желтовская, Калинина
ГДЗ часть 1 / страница 72 5 математика 1 класс Моро, Волкова
ГДЗ упражнение 23 русский язык 5 класс Практика Купалова, Еремеева
ГДЗ обучающие работы / О-7 8 алгебра 7 класс дидактические материалы Евстафьева,, Карп
ГДЗ упражнение 867 алгебра 7 класс Макарычев, Миндюк
ГДЗ страница 106 английский язык 9 класс рабочая тетрадь новый курс (5-ый год обучения) Афанасьева, Михеева
ГДЗ задание 212 информатика 9 класс рабочая тетрадь Босова, Босова
ГДЗ часть 1. задание 163 математика 3 класс рабочая тетрадь Захарова, Юдина
ГДЗ вариант 1 / самостоятельные работы / С-27 4 алгебра 7 класс дидактические материалы к учебнику Макарычева Звавич, Дяконова
ГДЗ вправа 155 украинский язык 7 класс Заболотный, Заболотный
ГДЗ часть №1 § 13 окружающий мир 3 класс Вахрушев, Данилов
ГДЗ § 40 4 алгебра 7 класс дидактические материалы Ткачева, Федорова
География ГДЗ Тетрадь Климанова Ким
ГДЗ учебник 2015. упражнение 1013 (164) математика 5 класс Виленкин, Жохов
упражнение 1013 (164) математика 5 класс Виленкин, Жохов
ГДЗ По Русскому 8 Класс Лыжневская
ГДЗ Окружающий Федотова Рабочая Тетрадь
Бесплатное ГДЗ По Русскому 8
Ким по химии огэ. Оге по химии. Рабочие инструкции
Для кого предназначены эти тесты?Данные материалы предназначены для студентов, готовящихся к ОГЭ-2018 по химии . Также их можно использовать для самоконтроля при изучении школьного курса химии. Каждая посвящена определенной теме, с которой девятиклассник встретится на экзамене. Номер теста – это номер соответствующего задания в бланке ОГЭ.
Как устроены тематические испытания? Будут ли на этом сайте публиковаться другие тематические тесты?Несомненно! Планирую разместить тесты по 23 темам по 10 заданий в каждой. Следите за обновлениями!
 Химические свойства средних солей. (Готовится к выпуску!)
Химические свойства средних солей. (Готовится к выпуску!)Вам кажется, что чего-то не хватает? Хотите расширить некоторые разделы? Нужен новый контент? Что-то нужно исправить? Нашли ошибки?
Всем удачи в подготовке к ОГЭ и ЕГЭ!
В этом разделе я систематизирую разбор заданий из ОГЭ по химии. Аналогично разделу вы найдете подробные разборы с инструкциями по решению типовых задач по химии в ОГЭ 9 класс. Прежде чем разбирать каждый блок типовых задач, я даю теоретическую базу, без которой решение данной задачи невозможно. Теории ровно столько, сколько достаточно знать для успешного выполнения задания с одной стороны. С другой стороны, я постарался изложить теоретический материал интересным и понятным языком. Уверен, что пройдя обучение по моим материалам, вы не только успешно сдадите ОГЭ по химии, но и полюбите этот предмет.
Уверен, что пройдя обучение по моим материалам, вы не только успешно сдадите ОГЭ по химии, но и полюбите этот предмет.
Общие сведения об ЕГЭ
ОГЭ по химии состоит из трех частей .
В первой части 15 заданий с одним ответом — это первый уровень и задания в нем простые, при наличии, разумеется, базовых знаний по химии. Эти задания не требуют вычислений, кроме задания 15.
Вторая часть состоит из четырех вопросов — в первых двух — 16 и 17 надо выбрать два правильных ответа, а в 18 и 19соотносить значения или утверждения из правого столбца с левым.
Третья часть решение задач . В 20 нужно уравнять реакцию и определить коэффициенты, а в 21 решить задачу на расчет.
Четвертая часть — практичная , простая, но нужно быть внимательной и осторожной, как всегда при работе с химией.
Всего выполнено 140 минут.
Ниже разобраны типовые варианты задач, сопровождаемые необходимой для решения теорией. Все задания тематические — перед каждым заданием есть тема для общего понимания.
Все задания тематические — перед каждым заданием есть тема для общего понимания.
Тренировочный тест для подготовки к ОГЭ — 2017 по химии в 9 классе
Подготовила:
Трибунская Елена Жановна,
учитель химии МАОУ СОШ №7
г. Балаково Саратовской области
Задача:
1) повторить изученный материал
2) познакомить учащихся со структурой экзамена бумага
3) помочь учащимся подготовиться к ОГЭ.
Рабочие инструкции
На выполнение работы дается 2 часа (120 минут). Работа состоит из 2 частей, включающих 22 задания. Часть 1 содержит 19 заданий с короткими ответами, часть 2 содержит 3 задания с длинными ответами.
Ответы на задания 1-15 записываются одной цифрой, что соответствует номеру правильного ответа.
Ответы на задания 16-19 записываются в виде последовательности чисел.
Для заданий 20-22 необходимо дать полный развернутый ответ, включая необходимые уравнения реакций и решение задачи.
При выполнении работ можно пользоваться Периодической таблицей химических элементов Д.И. Менделеева, таблица растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов и непрограммируемый калькулятор.
Бывшие в употреблении учебники и интернет-ресурсы :
Габриелян О.С. «Химия 9 класс». М., Дрофа. 2013 год.
О.С. Габриелян «Химия 8 класс». М., Дрофа. 2013 год.
ОТКРЫТЫЙ БАНК заданий по химии ОГЭ
Часть 1
1. Атому соответствуют три электронных слоя и один электрон во внешнем электронном слое:
1) хлор; 3) натрий;
2) литий; 4) водород.
Ответ:
2. В каком ряду усиливаются металлические свойства соответствующих простых веществ:
1) бериллий — магний — кальций;
2) фтор-бром-хлор;
3) сера — кислород — селен;
4) углерод-свинец-кремний.
Ответ:
3. Соединения с ковалентной полярной и ковалентной неполярной связью соответственно
1) RbClAndCl 2 3) О 3 ИН 2 С
2) HBrAndN 2 4) НХ 3 ИН 2 О
Ответ:
4 . Степень окисления +5 фосфор проявляет в соединении
Степень окисления +5 фосфор проявляет в соединении
1) P 2 О 3 3) На 3 Р
2) РН 3 4) Мг(Н2 ПО 4 ) 2
Ответ:
5. Вещества, формулы которых -BeOAndBaO, равны соответственно:
1) основной оксид и кислый оксид
2) амфотерный оксид и основной оксид
3) кислый оксид и основной оксид
4) основной оксид и амфотерный оксид
Ответ:
6. Реакция, уравнение которой 2Rb+2 Н 2 О=2 RbOH+ Н 2 относится к реакциям:
1) замещения, экзотермические;
2) разложение экзотермическое;
3) присоединение эндотермическое;
4) обменный, эндотермический.
Ответ:
7 . ионы SO 3 2- образуются при диссоциации в водном растворе:
1) сульфид калия; 3) сульфат калия;
2) кислота серная; 4) сульфит калия.
Ответ:
8. Газ выделяется при взаимодействии:
1) цинка гидроксида и соляной кислоты; 3) гидроксид меди (II) и азотная кислота;
2) сульфид меди и кислота соляная 4) окись калия и кислота азотная.
Ответ:
9. Кальций взаимодействует с каждым из веществ, формулы которых указаны в группе:
1) ТО, О 2 , HCl; 3) О 2 , Н 2 О, Н 2 ;
2) Cu, O 2 , N 2; 4)Н 2 OTOOH, S.
Ответ:
10 .Оксид бериллия реагирует с каждым из двух веществ:
1) NaAndH 2 О 3) HClAndO 2
2) Н 2 OAndHNO 3 4) KOHAndH 2 ТАК 4
Ответ:
11 . Раствор азотной кислоты реагирует с каждым из двух веществ:
1) AgAndRbOH;
2) № 2 OAndCO 2 ;
3) NiO и HCI;
4) Ва(NO 3 ) 2 AndNH 3 .
Ответ:
12. Среди веществ: хлорид натрия, сульфид натрия, сульфат натрия — в реакцию с нитратом меди (II) вступают(ют)
1) два вещества; 3) одно вещество;
2) три вещества; 4) нет вещества.
Ответ:
13. Верны ли следующие утверждения?
A. Вы можете отделить спирт от воды отстаиванием.
Б. Водный раствор соли и мела можно разделить фильтрованием
1) верно только А; 3) оба суждения верны;
2) верно только В; 4) оба суждения неверны.
Ответ:
14. Аммиак – окислитель, в схеме реакции которого:
1) N 2 +Н 2 →NH 3 ; 3) НХ 3 +CuO→Cu+ N 2 +Н 2 О;
2) НХ 3 +О 2 →N 2 +Н 2 О; 4) НХ 3 +К→КНХ 2 +Н 2 .
Ответ:
15 . На какой диаграмме распределение массовых долей элементов соответствует качественному составу фосфата аммония?
1) 3)
2) 4)
Ответ:
Часть 2
16. Среди химических элементов Cl — S-R
1) уменьшаются заряды ядер атомов;
2) увеличиваются кислотные свойства их оксидов;
3) снижается низшая степень окисления;
4) радиус атомов уменьшается;
5) повышены неметаллические свойства.
Ответ:
17. Для углеводорода С 2 Н 6 характеристика:
1) реакция замещения;
2) реакция дегидрирования;
3) обесцвечивание бромной воды;
4) реакция изомеризации;
5) реакция с водой.
Ответ:
18. Соедините два вещества с помощью реагента, который можно использовать для различения этих веществ
Соедините два вещества с помощью реагента, который можно использовать для различения этих веществ
Вещества: Реагент:
А)NaIAndNaClO 3 1) Са( Ой) 2
Б)HFAndRb 2 ТАК 4 2) AgNO 3
В) СО 2 AndCaC 2 3) фенолфталеин
4) Ba(NO3 ) 2
Ответ:
19. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
НАИМЕНОВАНИЕ РЕАГЕНТОВ
ВЕЩЕСТВА:
A) оксид цинка 1)K 2 О, Na
B) углекислый газ 2)SO 2 , Н 2 О
B) серная кислота 3)Ca( Ой) 2 , Н 2 О
4) HBr, Са( Ой) 2
Ответ:
Часть 2
20. Методом электронного баланса расставьте коэффициенты в уравнении реакции, схема которой
H 2 О 2 + НХ 3 → № 2 + Н 2 O
Определите окислитель и восстановитель.
21. Углекислый газ пропускали через раствор гидроксида кальция. Образовалось 648 г гидрокарбоната кальция с массовой долей 1%. Рассчитать объем прореагировавшего газа
Рассчитать объем прореагировавшего газа
22. Данные вещества: Ve,NaNO 3 , КОН, Н 2 ТАК 4 , На 2 ТАК 4 , MgO. Используя воду и необходимые вещества только из этого списка, получают гидроксид бериллия в две стадии. Опишите признаки продолжающихся реакций. Для реакции ионного обмена напишите сокращенное уравнение ионной реакции.
Система оценки химических тестов
Правильное выполнение каждой задачи частей 1 базовый уровень сложности (1–15) оценивается в 1 балл.
Правильное выполнение каждой задачи частей 1 продвинутый уровень сложности (16–19) оценивается максимум в 2 балла. Задания 16 и 17 считаются правильно выполненными, если в каждом из них правильно выбрано два ответа. За неполный ответ — правильно назван один из двух ответов или названы три ответа, из них два правильных — дается 1 балл. Остальные ответы считаются неверными и оцениваются в 0 баллов.
Задачи 18 и 19считаются завершенными правильно, если правильно установлены три совпадения.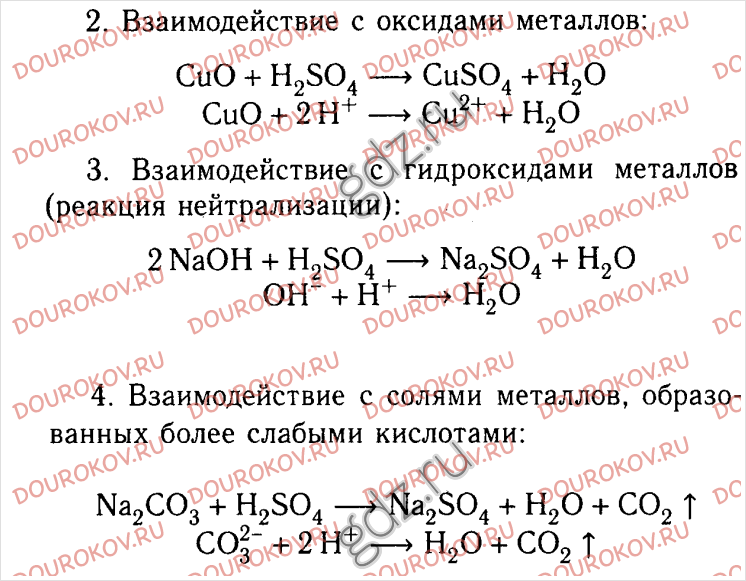 Частично правильным является ответ, в котором установлено два совпадения из трех; стоит 1 балл. Остальные варианты считаются неправильным ответом и оцениваются в 0 баллов.
Частично правильным является ответ, в котором установлено два совпадения из трех; стоит 1 балл. Остальные варианты считаются неправильным ответом и оцениваются в 0 баллов.
Часть 1
Часть 2
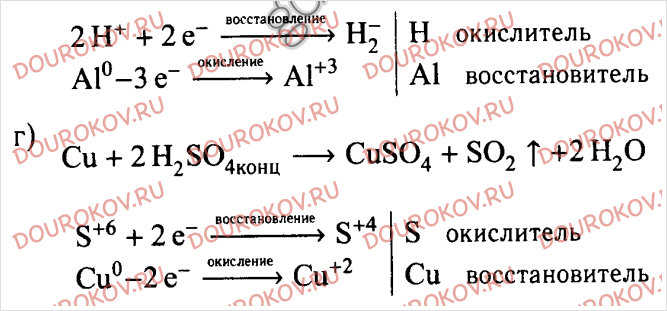
20. Методом электронных весов расставить коэффициенты в уравнении реакции, схема которого:
H 2 О 2 + НХ 3 → № 2 + Н 2 О
Укажите окислитель и восстановитель.
Элементы ответ
1. Составленный электронный баланс.
3 │2О -1 + 2Э → 2О -2
1 │2 Н-3 — 6ē →N 2 0
2. Коэффициенты расставлены в уравнении реакции:
3 Н 2 О 2 + 2 НХ 3 → № 2 + 6 Н 2 O
3. Указано, что восстановителем является N -3 , а окислитель O -1
Критерии оценки
Очки
Ответ содержит ошибку только в одном из элементов
В ответе две ошибки.
Максимальный балл
21. Углекислый газ пропускали через раствор гидроксида кальция. Образовалось 648 г гидрокарбоната кальция с массовой долей 1%. Рассчитать объем прореагировавшего газа
Образовалось 648 г гидрокарбоната кальция с массовой долей 1%. Рассчитать объем прореагировавшего газа
Элементы ответа
(Допускаются другие формулировки ответа, не искажающие его смысла)
1) Уравнение реакции 2CO 2 + Са( Ой) 2 знак равно Са( ХСО 3)2
2) Рассчитывали массу и количество субстанции бикарбоната калия, полученной в результате реакции:
мкл.(Ca( ХСО 3)2 знак равно мр-ра (Ca(HCO3)2 ) * ш (Са(НСО3)2 )= 648 * 0,01=6,48 г.
М(Ca(HCO3)2 )=164 г/моль
n(Ca(HCO3)2 )= 6,48 г/ 164 г/моль= 0,04 моль
3) Рассчитайте объем CO 2
н(СО 2 )=2 n(Ca(HCO3)2 )=2 * 0,04=0,08 моль
V(CO 2 )=n * V м = 0,08 * 22,4 = 1,8 л.
Критерии оценки
Очки
Ответ правильный и полный, включает все названные элементы
3
Правильно написаны 2 из названных выше элементов
2
Правильно написан 1 элемент из вышеперечисленного (1-й или 2-й)
1
Все элементы ответа написаны неверно
0
Максимальный балл
3
22. Даны
вещества:
Ve, NaNO 3
, КОН, Н 2
ТАК 4
, На 2
ТАК 4
, MgO. Используя воду и необходимые вещества только из этого списка, получают гидроксид бериллия в две стадии. Опишите признаки продолжающихся реакций. Для реакции ионного обмена напишите сокращенное уравнение ионной реакции.
Даны
вещества:
Ve, NaNO 3
, КОН, Н 2
ТАК 4
, На 2
ТАК 4
, MgO. Используя воду и необходимые вещества только из этого списка, получают гидроксид бериллия в две стадии. Опишите признаки продолжающихся реакций. Для реакции ионного обмена напишите сокращенное уравнение ионной реакции.
Элементы ответа
(Допускаются другие формулировки ответа, не искажающие его смысла)
1) Составлена цепочка преобразований:
ве весо 4 Ве (О) 2
Составлены два уравнения реакции:
2) Ве+Н 2 ТАК 4 знак равно ВЕСО 4 +Н 2
3) ВЕСО 4 + 2КОН = Ве(ОН) 2 ↓+ К 2 ТАК 4
4) Описаны признаки реакций:
для первой реакции: цинк растворяется, выделяется бесцветный газ;
для второй реакции: выпадение белого осадка.
5) Составлено сокращенное ионное уравнение второй реакции:
Ve 2 + + 2 О — знак равно Ве(ОН) 2 ↓
Критерии оценки
Баллы
Ответ правильный и полный, включает все названные элементы
5
Четыре элемента ответа написаны правильно
4
Правильно написаны три элемента ответа
3
Правильно написаны два элемента ответа
2
Один элемент ответа написан правильно
1
Все элементы ответа написаны неверно
0
Максимальный балл
5
Государственная итоговая аттестация 2019 года по химии для выпускников 9 классов общеобразовательных учреждений проводится в целях оценки уровня общеобразовательной подготовки выпускников по данной дисциплине. Задания проверяют знание следующих разделов химии:
Задания проверяют знание следующих разделов химии:
- Строение атома.
- Периодический закон и Периодическая система химических элементов Д.И. Менделеев.
- Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
- Валентность химических элементов. Степень окисления химических элементов.
- Простые и сложные вещества.
- Химическая реакция. Условия и признаки химических реакций. Химические уравнения.
- Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средняя).
- Реакции ионного обмена и условия их проведения.
- Химические свойства простых веществ: металлов и неметаллов.
- Химические свойства оксидов: основные, амфотерные, кислотные.
- Химические свойства оснований. Химические свойства кислот.
- Химические свойства солей (средние).
- Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории.
 Химическое загрязнение окружающей среды и его последствия.
Химическое загрязнение окружающей среды и его последствия. - Степень окисления химических элементов. Окислитель и восстановитель. Окислительно-восстановительные реакции.
- Расчет массовой доли химического элемента в веществе.
- Периодический закон Д.И. Менделеев.
- Исходные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы.
- Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид, сульфат, карбонизация, ион аммония). Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак).
- Химические свойства простых веществ. Химические свойства сложных веществ.
| Дата сдачи ОГЭ по химии 2019: 4 июня (вторник). | Изменений в структуре и содержании экзаменационной работы в 2019 году по сравнению с 2018 годом нет. |
В этом разделе вы найдете онлайн-тесты, которые помогут вам подготовиться к сдаче ОГЭ (ГИА) по химии. Желаем вам успеха!
Желаем вам успеха!
Стандартный тест ОГЭ (ГИА-9) формата 2019 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2019 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т. е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т. е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2018 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2017 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т. е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2016 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т. е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2015 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2015 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.е. первые 19 заданий). Согласно действующей структуре экзамена, среди этих заданий предлагается всего 15 ответов. Однако для удобства прохождения тестов администрация сайта решила предлагать ответы во всех заданиях. Но для заданий, в которых варианты ответов не предусмотрены составителями реальных контрольно-измерительных материалов (КИМ), количество вариантов ответов значительно увеличено, чтобы максимально приблизить наш тест к тому, с чем вам придется столкнуться на конец учебного года.
Стандартный тест ОГЭ (ГИА-9) формата 2015 года по химии состоит из двух частей. Первая часть содержит 19 заданий с кратким ответом, вторая часть содержит 3 задания с развернутым ответом. В связи с этим в данном тесте представлена только первая часть (т.


 Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008.
Химия. 8-9 классы, Программыкурса химии для 8-11 классов общеобразовательных учреждений/ Еремин В.В., Кузьменко Н.Е., Лунин В.В., Дроздов А.А., Теренин В.И.. –М.: Дрофа, 2008. символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций;
символику: знаки хим.элементов, формулы хим.веществ и уравнения хим.реакций; элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ;
элементы (от водорода до кальция) на основе их положения в периодической системе элементов Д.И.Менделеева и особенностей строения их атомов; хим. Свойства основных классов неорганических веществ;
 Инструктаж по ТБ. Первая помощь при ожогах, отравлениях, порезах.
Инструктаж по ТБ. Первая помощь при ожогах, отравлениях, порезах.
 Чистые вещества и смеси. Методы разделения смесей.
Чистые вещества и смеси. Методы разделения смесей.

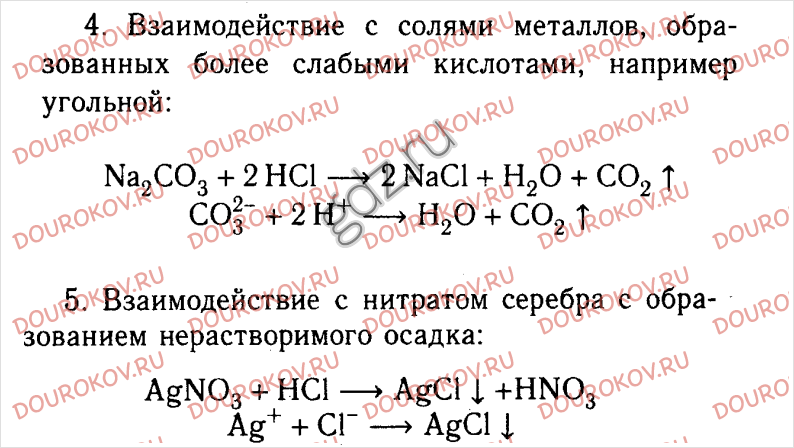









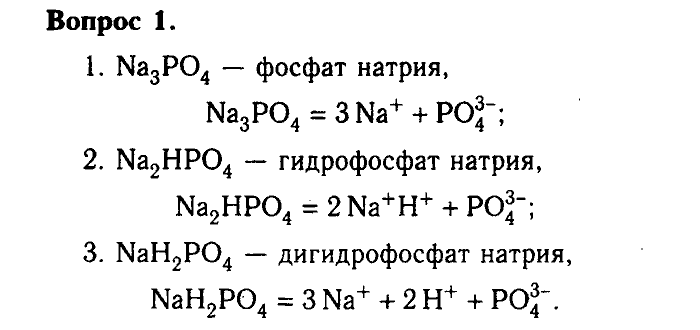

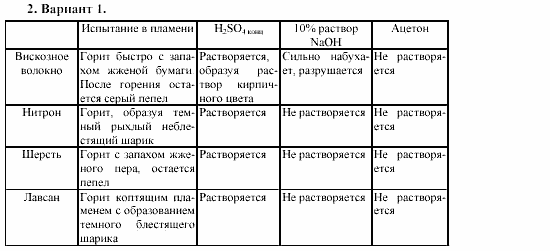 Химическое загрязнение окружающей среды и его последствия.
Химическое загрязнение окружающей среды и его последствия.