ГДЗ ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §12 Кислотность среды. Водородный показатель РЕШЕБНИК ОТВЕТЫ » Крутые решение для вас от GDZ.cool
ГДЗ ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §12 Кислотность среды. Водородный показатель РЕШЕБНИК ОТВЕТЫ
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Водный раствор имеет щелочную среду. О присутствии каких ионов это свидетельствует? Гидроксид-ионов OH—.
Задание 2
Из приведённого списка NaCl, HCl, NaOH, HNO3, H3PO4, H2SO4, Ba(OH)2, H2S, KNO3 выпишите формулы веществ, растворы которых имеют среду:
а) кислотную;
HCl, HNO3, H3PO4, H2SO4, H2S
б) щелочную.
NaOH, Ba(OH)2.
Задание 3
Дождевая вода имеет pH=5,6. Что это значит? Среда раствора слабокислотная.
В воздухе содержится углекислый газ (объемная доля около 0,03%), который с водой образует слабую угольную кислоту:
СО2 + Н2О = Н2СО3
Задание 4
В состав каменного угля, используемого на теплоэлектростанциях, входят соединения азота и серы. Выброс в атмосферу продуктов его сжигания приводит к выпадению кислотных дождей, содержащих небольшие количества азотной или серной кислот. Какие значения pH имеет кислотная дождевая вода – больше или меньше 7,0? Меньше 7,0.
Задание 5
Зависит ли pH раствора сильной кислоты от её концентрации? Не зависит от концентрации, т.к. степень диссоциации сильной ктслоты близка к единице и любой такой раствор имеет сильнокислотную среду.
Задание 6
Какую окраску имеет лакмус в растворах:
а) NaOH;
Синюю окраску (окраску сильнощелочной среды).
б) HCl;
Красную окраску (окраску сильнокислотной среды).
в) NaCl?
Фиолетовую окраску (окраску нейтральной среды).
Задание 7
Напишите уравнение диссоциации гидроксида бария.
Ba(OH)2 ⟶ Ba2+ + 2OH—
Какой цвет имеют лакмус, фенолфталеин и метилоранж в растворе этого вещества? В растворе гидроксида бария лакмус имеет синий цвет, фенолфталеин ― малиновый, метилоранж ― желтый.
Задание 8
В двух пробирках находятся растворы азотной кислоты и нитрата калия. Какой индикатор нужно использовать, чтобы определить, где находится раствор соли? Нужно использовать индикаторы лакмус или метилоранж, которые в отличие от фенолфталеина, в растворе азотной кислоты изменят свою окраску и дадут возможность определить раствор соли.
Задание 9
В трёх пробирках находятся растворы гидроксида бария, азотной кислоты и нитрата кальция. Как с помощью одного реактива можно распознать эти растворы? Лакмус в растворе гидроксида бария становится синим, а в растворе азотной кислоты ― красным.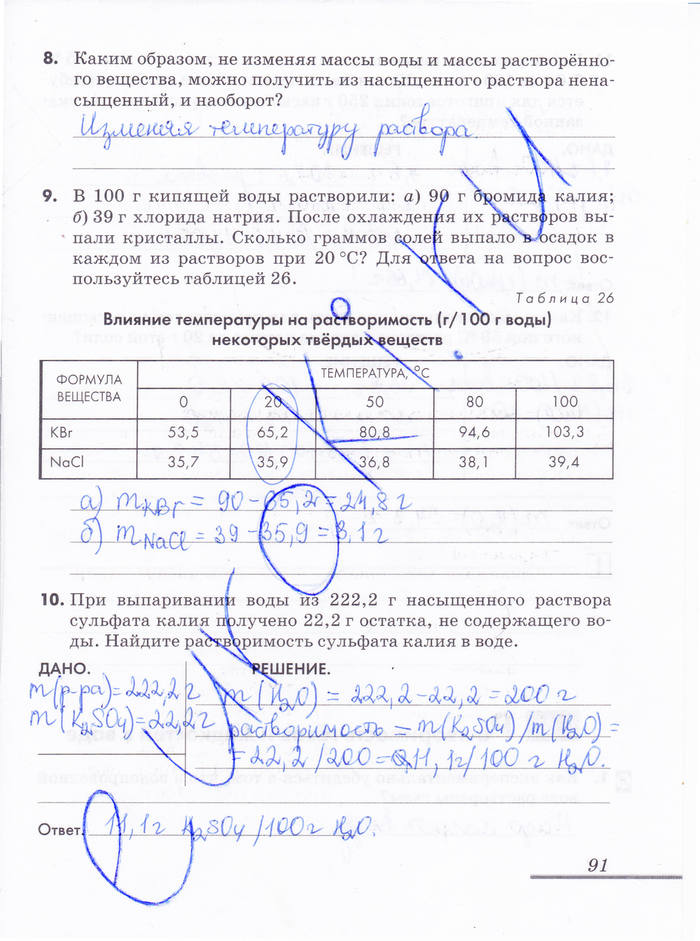
Задание 10
К раствору, содержащему 1 моль гидроксида калия, прилили фенолфталеин. Изменится ли окраска раствора, если к нему затем добавить соляную кислоту, содержащую:
а) 0,5 моль;
Не изменится.
б) 1 моль;
Изменится (обесцветится).
в) 1,5 моль HCl?
Изменится (обесцветится).
Уравнение реакции: KOH + HCl = KCl + H2O
На соотношение количества вещества реагентов указывают коэффициенты химического уравнения, поэтому в реакцию нейтрализации вступают щёлочь и кислота одинакового количества вещества.
а) с 0,5 моль соляной кислоты прореагирует 0,5 моль гидроксида калия, следовательно, 0,5 моль щёлочи останется в растворе, поэтому цвет фенолфталеина не изменится.
в) с 1 моль гидроксида калия прореагирует 1 моль соляной кислоты и в растворе останется 0,5 моль кислоты, следовательно, среда станет кислой и фенолфталеин приобретет цвет обесцветится.

Задание 11
Имеются три раствора одинаковой концентрации: KOH, HNO3, H2S. Расположите их в порядке увеличения pH раствора. HNO3, H2S, KOH.
Ответ подтвердите уравнениями электролитической диссоциации.
HNO3 ⟶ H+ + NO3—
H2S ⇄ H+ + HS—
KOH ⟶ K+ + OH—
Другие задания смотри здесь…
Решебник (ГДЗ) по химии рабочая тетрадь 9 класс Еремин Дроздов Шипарева
Авторы: Еремин В.В., Дроздов А.А., Шипарева Г.А.
Дрофа, 2013
Рабочая тетрадь по химии за 9 класс авторов Еремина В.В., Дроздова А.А., Шипаревой Г.А. 2013 года издания. Готовый сборник состоит из четырех глав с верными ответами, которые размещены на 176 страницах. Всего в рабочей тетради представлено 45 параграфов, среди которых: «Молярная масса», «Применение металлов в технике», «Фосфорная кислота» и т.

