Тест Названия химических элементов по химии онлайн
Сложность: знаток.Последний раз тест пройден 16 часов назад.
Перед прохождением теста рекомендуем прочитать:Вопрос 1 из 10
Как называется правильное наименование химических веществ?
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 55% участников
- 45% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветитьВопрос 2 из 10
Какой буквой обозначают химический элемент «сера»?
- Правильный ответ
- Неправильный ответ
- Вы и еще 94% ответили правильно
- 94% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 3 из 10
Как переводится слово «номенклатура» с латыни?
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 51% участников
- 49% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 4 из 10
Как называется вещество под следующей формулой: Na2SO4*10h3O?
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 54% участников
- 46% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 5 из 10
Сколько соединений было известно к концу 18 века?
- Правильный ответ
- Неправильный ответ
- Вы и еще 54% ответили правильно
- 54% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 6 из 10
Кто впервые выработал систему научных названий?
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 76% участников
- 24% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 7 из 10
В каком году была выработана система научных названий?
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 58% участников
- 42% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 8 из 10
На каком языке записываются названия химических элементов?
- Правильный ответ
- Неправильный ответ
- Вы и еще 89% ответили правильно
- 89% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 9 из 10
Как на ранней стадии развития химии назывались легколетучие жидкости?
- Правильный ответ
- Неправильный ответ
- Вы и еще 55% ответили правильно
- 55% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 10 из 10
Как называется водный раствор аммиака?
- Правильный ответ
- Неправильный ответ
- Вы и еще 84% ответили правильно
- 84% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Светлана Мотовилова
10/10
Наташа Огнева
10/10
Валентина Чернуцкая
10/10
Александр Яковенко
7/10
Оксана Бальжиева
8/10
Мурат Латыпов
Александр Котков
10/10
Регина Медникова
10/10
Александр Котков
10/10
Любовь Лосева
10/10
Рейтинг теста
Средняя оценка: 3.4. Всего получено оценок: 1779.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Тест Химия в жизни человека по химии онлайн
Сложность: знаток.Последний раз тест пройден более 24 часов назад.
Перед прохождением теста рекомендуем прочитать:Вопрос 1 из 5
Как называется раздел химии, изучающий метаболизм и действие отдельных веществ на организм человека?
- Правильный ответ
- Неправильный ответ
- Вы и еще 69% ответили правильно
- 69% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветитьВопрос 2 из 5
Какие главные вещества используются для производства зубной пасты?
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 64% участников
- 36% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 3 из 5
Что используется в качестве топлива?
- Правильный ответ
- Неправильный ответ
- Вы и еще 73% ответили правильно
- 73% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 4 из 5
Что используется для изготовления чистящих веществ?
- Металлы, водород, ферменты
- Песок, сода, щёлочь, ПАВ
- Воск, глицерин, эфирные масла
- Сульфаты, щёлочь, глицерин, ПАВ
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 69% участников
- 31% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 5 из 5
Какие вещества являются ароматизаторами в пищевой промышленности?
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 55% участников
- 45% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Олег Гаврюшкин
5/5
Александр Котков
5/5
Миша Греков
4/5
Александр Котков
5/5
Регина Медникова
5/5
Евгения Медникова
5/5
Виктория Кабакова
4/5
Ралина Гатауллина
1/5
Александр Котков
5/5
Балаханым Мамедова
5/5
Рейтинг теста
Средняя оценка: 3.1. Всего получено оценок: 1157.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Тестовые задания с ответами по химии 8 класс
ХИМИЯ. Вариант № 1 (2016-2017 гг.)
Инструкция: «Вам предлагаются задания с одним правильным ответом из пяти предложенных.
1. Каким методом можно очистить смесь древесных и железных стружек?
A) фильтрование
B) перекристаллизация
C) отстаивание
D) выпаривание
E) перегонка
2. Мельчайшая частица, сохраняющая свойства и состав данного вещества:
Мельчайшая частица, сохраняющая свойства и состав данного вещества:
A) нейтрон
B) протон
C) атом
D) электрон
E) молекула
3. Ввел понятие химический элемент в науку:
A) Р. Бойль
B) Дж. Дальтон
C) Й. Берцелиус
D) Д.И. Менделеев
E) Авогадро
4. По его предложению, элемент принято символически обозначать одной или двумя начальными буквами их латинских названий:
A) Р. Бойль
B) Дж. Дальтон
C) Й. Берцелиус
D) Д.И. Менделеев
E) Авогадро
5. Чему равна молекулярная масса соляной кислоты?
A) 36
B) 98
C) 34
D) 82
E) 100
6. Какому элементу соответствует электронная конфигурация 1s22s22p63s23p64s23d6?
A) железо
B) криптон
C) теллур
D) кремний
E) азот
7. Укажите сульфат кальция:
A) Са(ОН)2
B) СаО
C) А l(ОН)3
D) Na2O
E) СаSO4
8. Чему равна массовая доля кислорода в гидроксиде алюминия?
Чему равна массовая доля кислорода в гидроксиде алюминия?
A) 40
B) 62
C) 120
D) 48
E) 78
9. Масса 0,1 моль оксида кальция равна
A) 4,6
B) 0,01
C) 0,1
D) 5,6
E) 0,5
10. Укажите реакцию замещения:
A) CaO + CO2 = CaCO3
B) H2O + CO2 = H2CO3
C) 2KCl + H
D) Li2O + H2 = 2Li + H2O
E) Zn(NO3)2 + H2O = ZnO + 2HNO3
11. В какой реакции сумма коэффициентов равна 5?
A) CaO + CO2 = CaCO3
B) H2O + CO2 = H2CO3
C) 2KCl + H2SO4 = K2SO4 + 2HCl
D) Li2O + H2 = 2Li + H2O
E) Zn(NO3)2 + H2O = ZnO + 2HNO3
12. Сколько протонов содержится в ядре атома элемента с электронной формулой 1s22s22р63s23р4?
Сколько протонов содержится в ядре атома элемента с электронной формулой 1s22s22р63s23р4?
A) 16
B) 18
C) 14
D) 12
E) 10
13. Веществом в схеме превращений Cr→Cr 2O3 Может быть
A) хлорид хрома
B) гидроксид хрома
C) хлорид натрия
D) оксид хрома
E) гидроксид натрия
14. Найдите наивысшую относительную молекулярную массу:
А) CaSO3
В) H2O
С) CuSO2
D) NaOH,
Е) H3PO4
15. Выберите формулу соли.
А) H2O
В) NaOH
С) H3PO4
Д) CuCl2
Е) Al2O3
16. Вычислите массу соли, образующейся при взаимодействии 16 г гидроксида натрия с соляной кислотой.
А) 56 г
В) 40 г
С) 23,2 г
Д) 25 г
Е) 928 г
17. Укажите формулу двухосновной кислоты.
Укажите формулу двухосновной кислоты.
А) HCl
В) H2SO4
С) HNO3
Д) H3PO
Е) HF
18. Как называются соли соляной кислоты?
А) хлориды
В) карбонаты
С) сульфаты
Д) нитраты
Е) сульфиты
19. Как называется вещество, имеющее формулу – K2SO4
А) сульфат кальция
В) нитрат кальция
С) сульфат калия
Д) хлорид калия
Е) сульфит калия
20. Какой металл не будет взаимодействовать с соляной кислотой?
А) железо
В) цинк
С) магний
Д) серебро
Е) натрий
Инструкция: «Вам предлагаются задания, в которых могут быть один или несколько правильных ответов.
1. Укажите химические явления:
A) образование пара
B) ржавление
C) осадки
D) облачность
E) плавление
F) гниение
G) испарение воды
H) скисание молока
2.
A) водород
B) кислород
C) марганцовка
D) магний
E) сера
F) железо
G) вода
H) медь
3. Свойства, характерные металлам:
A) ковкость
B) газы
C) плохо проводят тепло
D) плохо проводят электричество
E) теплопроводность
F) твердые, жидкие, газы
G) не ковкие
H) пластичность
4. Укажите соли:
A) HCl
B) CaCO3
C) CuO
D) Na3PO4
E) Zn(NO3)2
F) Са(ОН)2
G) СаО
H) H2SO4
5. Укажите кислоты:
A) HCl
B) CaCO3
C) CuO
D) Na3PO4
E) Zn(NO3)2
F) Са(ОН)2
G) СаО
H) H2SO4
6. В каких соединениях металлы проявляют валентность II?
A) Fe2O3
B) BaCl2
C) CuO
D) MnO2
E) H2O
F) ZnCl2
G) HCl,
H) P2O5
7. Укажите, в каких реакциях образуется сульфат натрия
Укажите, в каких реакциях образуется сульфат натрия
A) Fe + Cl2 → FeCl3
B) Ca(OH)2 + HCl → CaCl2 + H2O
C) Cr(OH)3 →Cr2O3 + H2O
D) Na + H2SO4 →Na2SO4 + H2
E) P + O2 → P2O5
F) NaOH + H2SO4 → Na2SO4 + H2O
G) Fe(OH)3 → Fe2O3 + H2O
H) Al + HCl → AlCl3 + H2
8. Какие из приведенных реакций относятся к реакциям обмена?
А) C + O2 → CO2
B) Cu(OH)2 → CuO + H2O
C) Fe + H2SO4 → FeSO4 + H2
D) NaOH + HCl → NaCl + H2O
E) h3 + O2 = h3O
F) Zn + HCl = ZnCl2 + H2
G) KCl + FeSO4 → K2SO4 + FeCl2
H) Li2O = Li + O2
9. Из каких частиц состоит атомное ядро:
Из каких частиц состоит атомное ядро:
A) протонов
B) нейтронов
C) только из протонов;
D) только из нейтронов
E) электронов
F) электронов и протонов
G) электронов и нейтронов
H) электронов, протонов и нейтронов
10. В каких оксидах валентность металла равна II?
A) Cu2O B) P2O5
C) Ag3PO4
D) Zn(OH)
E) CaO
F) K2O
G) ZnO
H) Na2SO4
ХИМИЯ Вариант № 2 (2016-2017 гг.)
Инструкция: «Вам предлагаются задания с одним правильным ответом из пяти предложенных.
1. Способ очистки, при котором вначале вещество растворяют в воде, затем выпаривают раствор:
A) фильтрование
B) перекристаллизация
C) отстаивание
D) выпаривание
E) перегонка
2. Мельчайшая, химически неделимая частица веществ:
A) нейтрон
B) протон
C) атом
D) электрон
E) молекула
3. Связал между собой понятия химический элемент и атом вещества:
Связал между собой понятия химический элемент и атом вещества:
A) Р. Бойль
B) Дж. Дальтон
C) Й. Берцелиус
D) Д.И. Менделеев
E) Авогадро
4. По его предложению, элемент принято символически обозначать одной или двумя начальными буквами их латинских названий:
A) Р. Бойль
B) Дж. Дальтон
C) Й. Берцелиус
D) Д.И. Менделеев
E) Авогадро
5. Чему равна молекулярная масса серной кислоты?
A) 36
B) 98
C) 34
D) 82
E) 100
6. Какому элементу соответствует электронная конфигурация 1s22s22p63s23p2?
A) железо
B) криптон
C) теллур
D) кремний
E) азот
7. Укажите гидроксид кальция:
A) Са(ОН)2
B) СаО
C) А l(ОН)3
D) Na2O
E) СаSO4
8. Чему равна массовая доля кислорода в сульфите кальция?
A) 40 B) 62 C) 120 D) 48 E) 78
9. Количество вещества в 1 г карбоната кальция равно:
Количество вещества в 1 г карбоната кальция равно:
A) 4,6 B) 0,01 C) 0,1 D) 5,6 E) 0,5
10. Укажите реакцию нейтрализации:
A) CaO + CO2 = CaCO3
B) H2O + CO2 = H2CO3
C) 2KCl + H2SO4 = K2SO4 + 2HCl
D) Li2O + H2 = 2Li + H2O
E) Zn(NO3)2 + H2O = ZnO + 2HNO3
11. Укажите реакцию соединения:
A) CaO + H2SO4 = CaSO4 + H2O
B) H2O + CO2 = H2CO3
C) 2KCl + H2SO4 = K2SO4 + 2HCl
D) Li2O + H2 = 2Li + H2O
E) Zn(NO3)2 + H2O = ZnO + 2HNO3
12. Сколько протонов содержится в ядре атома элемента с электронной формулой 1s22s22р63s23р6?
A) 16
B) 18
C) 14
D) 12
E) 10
13. Найдите наивысшую относительную молекулярную массу:
Найдите наивысшую относительную молекулярную массу:
А) Li2SO3
В) Mg(OН)2
С) KCl
Д) ZnO
Е) HNO3
14. Укажите формулу кислотного оксида.
А) NaOH
В) SO3
С) Na2O
Д) Al2O3
Е) H3PO4
15. Как называются соли угольной кислоты?
А) хлориды
В) карбонаты
С) сульфаты
Д) нитраты
Е) фосфаты
16. Как называется вещество, имеющее формулу – Сa(NO3)2
А) нитрат кальция
В) нитрат калия
С) сульфат кальция
Д) карбонат кальция
Е) нитрит кальция
17. Вычислите массу соли, образующейся при взаимодействии 16 г гидроксида натрия с соляной кислотой.
А) 56 г В) 40 г С) 23,2 г Д) 25 г Е) 928 г
18. С каким из приведенных веществ будет взаимодействовать соляная кислота?
А) HCl
В) P2O5
С) NaOH
Д) Cu
Е) Au
19. Какой металл можно использовать для вытеснения водорода из серной кислоты?
Какой металл можно использовать для вытеснения водорода из серной кислоты?
А) медь
В) цинк
С) ртуть
Д) серебро
Е) золото
20. Реакция, при которой из одного сложного вещества образуется несколько простых или менее сложных, называется реакцией…
А) соединения
В) разложения
С) замещения
Д) обмена
Е) нейтрализации
Инструкция: «Вам предлагаются задания, в которых могут быть один или несколько правильных ответов.
1. Укажите однородную смесь:
A) мел с водой
B) песок и вода
C) воздух
D) сахар с водой
E) поваренная соль
F) молоко и заварка
G) вода и лимонная кислота
H) марганцовка и вода
2. Признаки химических реакций:
A) появление осадка
B) изменение формы
C) выделение теплоты
D) изменение размера
E) увеличение массы
F) ничего не изменяется
G) меняется агрегатное состояние
H) выделение газа
3. Укажите химически неделимое вещество
Укажите химически неделимое вещество
A) вода
B) водород
C) поваренная соль
D) сахар
E) марганцовка
F) медь
G) соединение железа с серой
H) оксид меди
4. Свойства неметаллов:
A) теплопроводность
B) электропроводность
C) газы, твердые, жидкие
D) ковкость
E) пластичность
F) металлический блеск
G) не пластичные
H) простые вещества
5. Укажите оксиды:
A) HCl
B) CaCO3
C) CuO
D) Na3PO4
E) Zn(NO3)2
F) Са(ОН)2
G) СаО
H) H2SO4
6. В каких соединениях металлы проявляют валентность II и IV?
A) Fe2O3
B) BaCl2
C) Cu2O
D) MnO2
E) H2O
F) ZnCl2
G) HCl,
H) P2O5
7. Какие из приведенных реакций относятся к реакциям обмена?
А) C + O2 → CO2
B) Cu(OH)2 → CuO + H2O
C) Fe + H2SO4 → FeSO4 + H2
D) NaOH + HCl → NaCl + H2O
E) h3 + O2 = h3O
F) Zn + HCl = ZnCl2 + H2
G) KCl + FeSO4 → K2SO4 + FeCl2
H) Li2O = Li + O2
8. Из каких частиц состоит атомное ядро:
Из каких частиц состоит атомное ядро:
A) протонов
B) нейтронов
C) только из протонов;
D) только из нейтронов
E) электронов
F) электронов и протонов
G) электронов и нейтронов
H) электронов, протонов и нейтронов
9. В каких оксидах валентность металла равна II?
A) Cu2O B) P2O5 C) Ag3PO4 D) Zn(OH)2 E) CaO F) K2O G) ZnO H) Na2SO4
10. Укажите, в каких реакциях образуется сульфат натрия
A) Fe + Cl2 → FeCl3
B) Ca(OH)2 + HCl → CaCl2 + H2O
C) Cr(OH)3 →Cr2O3 + H2O
D) Na + H2SO4 →Na2SO4 + H2
E) P + O2 → P2O5
F) NaOH + H2SO4 → Na2SO4 + H2O
G) Fe(OH)3 → Fe2O3 + H2O
H) Al + HCl → AlCl3 + H2
ХИМИЯ. Вариант № 1 (2016-2017 гг.). Ответы
Вариант № 1 (2016-2017 гг.). Ответы
Химия 7-8 класс, школьный (первый) этап, г. Москва, 2017-2018 год
Содержание
- Задача 1. Реакции соединения
- Задача 2. Вещество из водорода и кислорода
- Задача 3. Фториды в природе и в быту
- Задача 4. Новое ракетное топливо
- Задача 5. Реакция горения
- Задача 6. Эксперименты с газами
В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается.
Задача 1. Реакции соединения
Содержание ↑
В реакциях соединения из нескольких веществ образуется одно. Приведите уравнения реакций соединения, в которых сумма коэффициентов равна: а) 5; б) 7; в) 9. Напомним, что коэффициенты должны быть целыми числами.
Чему равна минимально возможная сумма коэффициентов в уравнении реакции соединения? Приведите пример.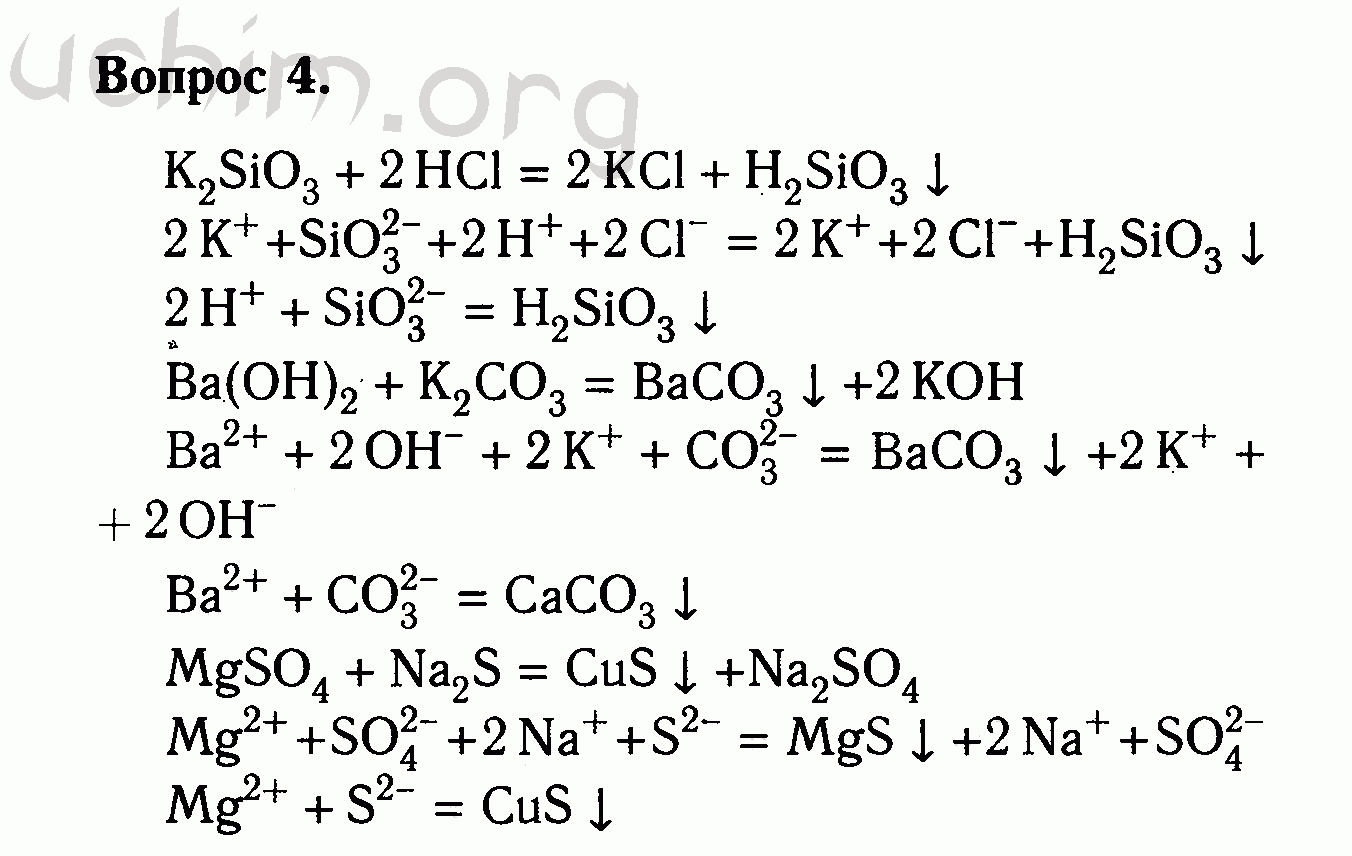
Может ли эта сумма быть чётным числом? Если да, то приведите пример.
Решение:
Содержание ↑
а) 2Cu + O2 = 2CuO или 2H2 + O2 = 2H2O
б) 4Li + O2 = 2Li2O
в) 4Al + 3O2 = 2Al2O3 или 4Fe + 3O2 = 2Fe2O3
Минимально возможная сумма коэффициентов – 3 (два реагента и один продукт), например
C + O2 = CO2 или S + O2 = SO2
Конечно, сумма коэффициентов может быть чётной, например:
Na2O + H2O = 2NaOH или H2 + Cl2 = 2HCl
или
N2 + 3H2 = 2NH3 или 3Fe + 2O2 = Fe3O4
Критерий оценивания: по 2 балла за каждое уравнение (в каждом пункте засчитывается только одно уравнение). Принимается любое разумное уравнение, удовлетворяющее условию задачи.
Итого 10 баллов
Задача 2. Вещество из водорода и кислорода
Содержание ↑
Сложное вещество, в молекуле которого на один атом кислорода приходится один атом водорода, представляет собой неустойчивую жидкость, неограниченно смешивающуюся с водой. Разбавленный (3%) раствор этого вещества используется в медицине. Составьте молекулярную и структурную формулу этого вещества. Что произойдёт, если в водный раствор этого вещества внести щепотку оксида марганца(IV)? Запишите уравнение реакции.
Решение
Содержание ↑
Вещество, о котором идёт речь, – пероксид водорода. Его молекулярная формула H2O2. (3 балла). Чтобы её составить, достаточно знать, что кислород имеет постоянную валентность, равную 2. Структурная формула
4 балла
При внесении оксида марганца пероксид водорода разлагается:
2H2O2 = 2H2O + O2: 3 балла
(1 балл, если записано неверное уравнение разложения на простые вещества).
Оксид марганца выступает в роли катализатора.
Итого 10 баллов
Задача 3. Фториды в природе и в быту
Содержание ↑
Природный минерал флюорит обладает интересными свойствами. Он имеет широкий спектр окраски: от розовых оттенков до фиолетовых. Окраску минералу придают примеси соединений различных металлов. После нагревания или облучения ультрафиолетовым светом минерал начинает светиться в темноте. Химический состав минерала: содержание кальция – 51,28 %, содержание фтора – 48,72 % по массе.
- Используя данные о химическом составе, выведите формулу минерала флюорита. Расчёты запишите.
- В каких средствах гигиены содержатся соединения фтора? В каких случаях нужно использовать это средство гигиены? Какое заболевание они предотвращают?
Решение
Содержание ↑
1) Ca : F = (51,28 / 40) : (48,72 : 19) = 1 : 2.
Простейшая формула флюорита – CaF2.
Определение формулы с расчётами – 5 баллов
Определение формулы без расчётов, по валентностям – 1 балл
2) Соединения фтора входят в состав зубных паст (2 балла), такие пасты употребляют при недостатке фтора (1 балл). При недостатке соединений фтора в организме развивается заболевание зубов – кариес (2 балла).
При недостатке соединений фтора в организме развивается заболевание зубов – кариес (2 балла).
Итого 10 баллов
Задача 4. Новое ракетное топливо
Содержание ↑
Новое экспериментальное ракетное топливо представляет собой смесь тонкоизмельчённого льда и порошка алюминия, частицы которого по размеру в 500 раз меньше толщины волоса. При поджигании происходит химическая реакция, в которой образуются оксид и простое вещество. Напишите уравнение этой реакции.
- В каком соотношении по массе надо смешать исходные вещества, чтобы они прореагировали полностью?
- Как Вы думаете, за счёт чего создаётся реактивная тяга?
- Новое топливо называется АЛИСА (пер. с англ.). Почему?
Решение
Содержание ↑
В результате реакции образуются оксид алюминия и водород. Уравнение реакции:
2Al + 3H2O = Al2O3 + 3H2↑ 4 балла
На 2 атома алюминия массой 2 · 27 = 54 а. е. м. приходится 3 молекулы воды массой 3 · 18 = 54 а. е. м. Соотношение масс 1 : 1. 4 балла
е. м. приходится 3 молекулы воды массой 3 · 18 = 54 а. е. м. Соотношение масс 1 : 1. 4 балла
Реакция идёт с большой скоростью, реактивная тяга создаётся выделяющимся водородом. 1 балл
AL + ICE = ALICE 1 балл
Итого 10 баллов
Задача 5. Реакция горения
Содержание ↑
При горении сложного вещества на воздухе образовались азот, углекислый газ и вода. Составьте формулу этого вещества, если известно, что в его состав входят атом углерода, атом азота и максимально возможное число атомов водорода. Помните, что валентность углерода равна 4, азота 3, а водорода 1. Составьте уравнение реакции горения.
Решение
Содержание ↑
Формула вещества, составленная согласно валентности, – CH5N
(5 баллов за любую правильную формулу – молекулярную или структурную).
(если в решении приводится формула HCN – 2 балла из 5)
Уравнение реакции горения:
4CH5N + 9O2 = 4CO2 + 2N2 + 10H2O 5 баллов
(если приведено правильное уравнение сгорания HCN – 5 баллов)
Итого 10 баллов
Задача 6.
 Эксперименты с газами
Эксперименты с газамиСодержание ↑
- Рисунок 1
- Рисунок 2
Пустую колбу закрыли пробкой с газоотводной трубкой, конец которой опустили в стакан с водой (см. рисунок 1). Когда колбу плотно обхватили рукой, то из отверстия трубки начали выделяться пузырьки газа (см. рисунок 2).
- Почему выделяются пузырьки газа, когда колбу обхватывают рукой? Какой газ выделяется?
- Выделение газа из газоотводной трубки в данном случае является физическим или химическим явлением? Ответ поясните.
- Ученик собрал прибор, описанный в условии задачи (колба с пробкой и газоотводной трубкой). Однако, как он ни старался обхватить колбу рукой, пузырьки газа из газоотводной трубки не выделялись. Предложите возможное объяснение такого результата.
- Возможно ли эксперимент провести так, чтобы вода из стакана начала засасываться по трубке в колбу? Если да, то опишите, как это можно сделать.
 Не разрешается разбирать прибор и заполнять его специально каким-либо газом.
Не разрешается разбирать прибор и заполнять его специально каким-либо газом. - Если колбу предварительно заполнить некоторым газом, а затем вставить пробку с газоотводной трубкой, конец которой опустить в воду, то можно наблюдать «фонтан». Вода под давлением будет подниматься в колбу и в конце опыта практически полностью заполнит её. Предложите вариант такого газа и объясните образование «фонтана» внутри колбы.
Решение
Содержание ↑
1) От тепла руки нагреваются стенки колбы и газ внутри колбы. При нагревании (если давление практически не изменяется) газы расширяются, их объём увеличивается. 2 балла
Выделяются пузырьки воздуха, т.е. того газа, которым была заполнена колба (и газоотводная трубка) до опыта. 1 балл
2) Это физический процесс, т.к. газы, входящие в состав воздуха, не претерпевают никаких химических превращений. Увеличивается только объём воздуха. 1 балл
3) Возможно, ученик собрал негерметичный прибор. Воздух мог проходить через неплотное соединение колбы с пробкой или пробки с газоотводной трубкой.
Воздух мог проходить через неплотное соединение колбы с пробкой или пробки с газоотводной трубкой.
Другое возможное объяснение связано с тем, что колба была предварительно нагрета. Тепла руки было недостаточно.
2 балла за любое разумное и обоснованное объяснение
4) Да, возможно. Для этого колбу нужно охладить, например, льдом или холодной водой. Также колбу можно предварительно нагреть, а затем опустить конец газоотводной трубки в стакан с водой.
2 балла за любой разумный вариант
5) Колбу можно заполнить газом, который хорошо растворяется в воде, например, аммиаком или хлороводородом. Газ растворится в небольшом объёме воды, его объём уменьшится, давление в колбе упадёт. Вода под действием атмосферного давления будет с силой засасываться внутрь колбы.
Альтернативное решение может быть связано с заполнением колбы горячим водяным паром. При охлаждении пар начнёт конденсироваться, его давление упадёт, и также будет наблюдаться «фонтан» внутри колбы.
2 балла
Итого 10 баллов
Содержание ↑
Тестовые задания по химии (8 класс)
МОУ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №7»
Г.НИЖНЕКАМСКА РЕСПУБЛИКИ ТАТАРСТАН
Составитель: учитель химии Губарева Вера Александровна.
Тестовые задания по химии для учащихся 8-го класса.
Пояснительная записка.
Тестовые задания составлены в программе HotPotatoes. Для выполнения тестов не требуется установки программы.
Составлено 10 тестов к различным темам курса.
Тест 1. Тема 1. Основные химические понятия.
Тест 2. Тема 2. Строение атома.
Тест 3. Тема 3. Химическая связь.
Тест 4. Тема 4. Периодический закон и Периодическая система химических элементов Д.И.Менделеева.
Тест 5. Тема 5. Простые вещества.
Тест 6. Тема 6. Соединения химических элементов.
Тест 7. Тема 7. Превращения веществ. Химические реакции.
Химические реакции.
Тест 8. Тема 8. Чистые вещества и смеси.
Тест 9. Тема 9. Реакции в растворах электролитов.
Работа 1. Общие положения теории электролитической диссоциации.
Тест 10. Тема 9. Реакции в растворах электролитов.
Работа 2. Ионные реакции и реакции окисления-восстановления.
Можно использовать как тренировочные задания. На экране высвечивается количество правильных ответов с первого раза и процент выполнения задания. Можно выработать систему оценивания знаний по количеству правильных ответов с первого раза, либо в % выполнения.
Мои предложения по оцениванию:
Результат выполнения заданий оценивается в %. Неудачные попытки и использование подсказок приводят к снижению оценки. Критерий оценивания: 96%-100% — «5»; 70%-95% — «4»; 50%-69% -«3». Если Ваш результат ниже 50%, то придется еще раз повторить изученный материал и проверить себя.
Данные тесты можно использовать не только для 8-го класса, но и для более старшего возраста в качестве повторения и подготовки к экзамену.
Тестовая работа по химии на тему: «Основания» 8 класс
тестовая работа по химии по теме : «Основания». 8 класс
- Какие вещества называются основаниями.
а) Сложные вещества состоящие из атомов металла и кислотного остатка,
б) Сложные вещества состоящие из атомов металла и одной или нескольких гидроксогрупп,
в) Сложные вещества состоящие из двух элементов, одним из которых является кислород,
г) Сложные вещества состоящие из атомов водорода и кислотного остатка.
- Формулы только оснований записаны в ряду
а) FeO, KOH, Ba(OH)2,
б) Na2O, CaO, CuO,
в) K2O, NaOH, Li2O,
г) Fe(OН)2, Cu(OН)2, NaOH.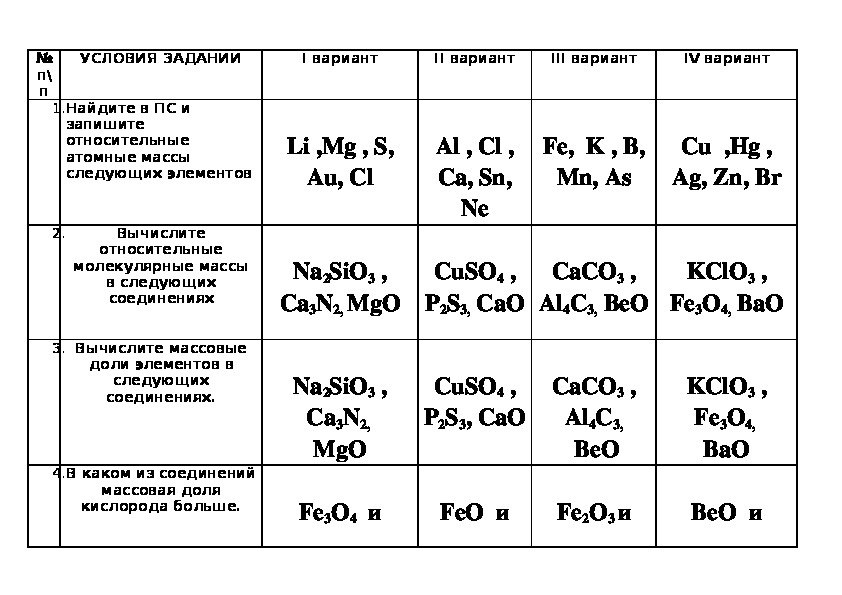
- Формулы только щелочей записаны в ряду
а) Ba(OH)2, KOН, NaOH,
б) Fe(OН)2, Cu(OН)2, NaOH,
в) SiO2, Na2O, Li2O,
г) FeO, CuO, SO3.
- Какие вещества называются щелочами
а) Растворимые в воде оксиды,
б) Нерастворимые в воде оксиды,
в) Растворимые в воде основания,
г) Растворимые в воде вещества.
- В щелочах окраска фенолфталеина изменяется на
а) красную,
б) малиновую,
в) желтую,
г) синюю.
- В щелочах окраска лакмуса изменяется на
а) красную,
б) малиновую,
в) желтую,
г) синюю.
- Вещество формула которого Mg (OH)2 называется
а) оксид магния,
б) гидроксид марганца,
в) оксид марганца,
г) гидроксид магния.
- Гидроксиду цинка соответствует формула
а) Zn(OH)2,
б) Zn 2O,
в) ZnOН,
г) ZnO2.
- Гидроксиду алюминия соответствует формула
а) Al (OH)3,
б) Ag (OH)3,
в) Ag (OH)2,
г) Ag OH.
- Гидроксиду железа (II) соответствует формула
а) Fe(OН)2,
б) Fe(OН)3,
в) Fe2OН,
г) FeO2.
Ответы к работе для контроля знаний по химии по теме : «Основания».
- б
- г
- а
- в
- б
- г
- г
- а
- а
- а
Химия, 8–9 класс: уроки, тесты, задания
Первоначальные химические понятия и теоретические представления
-
Предмет химии
-
Физические тела и вещества
-
Чистые вещества и смеси
-
Разделение смесей.
 Методы очистки веществ
Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
Простые и сложные вещества
-
Валентность.
 Степень окисления. Составление формул по валентностям и степеням окисления
Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ
-
Уравнения химических реакций
Классы неорганических веществ
-
Классификация веществ
-
Металлы
-
Неметаллы
-
Оксиды
-
Основания
-
Кислоты
-
Амфотерные гидроксиды
-
Соли
-
Взаимосвязь между классами неорганических веществ
Периодический закон и строение атомов
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
Строение вещества
-
Электроотрицательность химических элементов
-
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
Окислительно-восстановительные реакции
-
Степень окисления
-
Окислители и восстановители, окисление и восстановление
Растворы
-
Состав растворов
-
Растворение.
 Растворимость
Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов.
 Индикаторы
Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
Классификация химических реакций и закономерности их протекания
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции.
 Катализаторы
Катализаторы
Химия неметаллов
-
Водород
-
Кислород
-
Вода
-
Галогены.
 Хлор и его соединения
Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор и его соединения
-
Углерод и его соединения
-
Кремний и его соединения
Химия металлов
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
Органические вещества
-
Состав и строение органических веществ
-
Углеводороды.
 Полимеры
Полимеры
-
Спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы
-
Белки
Человек в мире веществ, материалов и химических реакций
-
Природные источники углеводородов
-
Химия и пища.
 Химия и здоровье
Химия и здоровье
Методы исследования в химии
-
Методы научного познания. Химический эксперимент
-
Получение, собирание и распознавание газов
-
Обнаружение ионов
Расчётные задачи по химии
-
Физические величины
-
Относительная атомная и молекулярная массы.
 Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
планов уроков | Химия средней школы
Используйте наши удаленные уроки, заполненные видео экспериментов, анимацией и вопросами, чтобы создать виртуальные уроки, которые студенты могут проводить дома! Посмотреть задания →
Стандарты NGSS и CCELA
Сортировать по ГОСТ
Найдите уроки, которые соответствуют вашим государственным стандартам.
Студенты знакомятся с идеей, что материя состоит из атомов и молекул, которые притягиваются друг к другу и находятся в постоянном движении.Учащиеся исследуют притяжение и движение атомов и молекул, экспериментируя и наблюдая за нагреванием и охлаждением твердого тела, жидкости и газа.
- Молекулы вещества
- Движущиеся молекулы
- Взлеты и падения термометров
- Движущиеся молекулы в твердом теле
- Воздух, это действительно так
Студенты помогают разрабатывать эксперименты, чтобы проверить, влияет ли температура воды на скорость испарения и влияет ли температура водяного пара на скорость конденсации.Учащиеся также более подробно рассматривают молекулу воды, чтобы объяснить изменения состояния воды.
- Тепло, температура и проводимость
- Изменение состояния — испарение
- Изменение состояния — конденсация
- Изменение состояния — замораживание
- Изменение состояния — плавление
Учащиеся экспериментируют с объектами, имеющими одинаковый объем, но разную массу, и другими объектами, имеющими одинаковую массу, но разный объем, чтобы развить смысл плотности. Студенты также экспериментируют с плотностью в контексте погружения и плавания и изучают вещества на молекулярном уровне, чтобы понять, почему одно вещество более или менее плотно, чем другое.
Студенты также экспериментируют с плотностью в контексте погружения и плавания и изучают вещества на молекулярном уровне, чтобы понять, почему одно вещество более или менее плотно, чем другое.
- Что такое плотность?
- Определение объема — метод вытеснения воды
- Плотность воды
- Плотность — погружение и всплытие твердых тел
- Плотность — слив и поплавок для жидкостей
- Температура и плотность
Учащиеся более глубоко изучают структуру атома и играют в игру, чтобы лучше понять взаимосвязь между протонами, нейтронами, электронами и уровнями энергии в атомах и их положением в периодической таблице.Студенты также изучат ковалентные и ионные связи.
- Протоны, нейтроны и электроны
- Периодическая таблица
- Периодическая таблица и модели уровней энергии
- Уровни энергии, электроны и ковалентные связи
- Уровни энергии, электроны и ионные связи
- Представьте соединение с точечными диаграммами Льюиса
Студенты исследуют полярность молекулы воды и разрабатывают тесты для сравнения воды с менее полярными жидкостями по скорости испарения, поверхностному натяжению и способности растворять определенные вещества. Студенты также обнаруживают, что растворение применимо к твердым телам, жидкостям и газам.
Студенты также обнаруживают, что растворение применимо к твердым телам, жидкостям и газам.
- Вода — полярная молекула
- Поверхностное натяжение
- Почему вода растворяет соль?
- Почему вода растворяет сахар?
- Использование растворения для идентификации неизвестного
- Влияет ли температура на растворение?
- Могут ли жидкости растворяться в воде?
- Могут ли газы растворяться в воде?
- Изменения температуры при растворении
Студенты изучают концепцию, согласно которой химические реакции включают разрыв связей между атомами в реагентах, а также перегруппировку и повторное связывание этих атомов с образованием продуктов.Учащиеся исследуют реакции, которые вызывают образование газа, образование осадка и изменение цвета. Студенты также изучают эндотермические и экзотермические реакции и занимаются инженерными работами по разработке устройства с использованием экзотермической реакции.
- Что такое химическая реакция?
- Контроль количества продуктов в химической реакции
- Образует осадок
- Температура и скорость химической реакции
- Катализатор и скорость реакции
- Использование химического изменения для идентификации неизвестного
- Изменение энергии в химических реакциях
- pH и изменение цвета
- Нейтрализующие кислоты и основания
- Двуокись углерода может сделать раствор кислым
Уроки на основе проекта
- Химические реакции и инженерное проектирование
- Природные ресурсы и синтетические материалы
обучающее исследование по химии растворов в 8 классе
Эбенезер, Дж. В. и Эрикссон, Л. (1996), «Представления студентов-химиков о растворимости:
В. и Эрикссон, Л. (1996), «Представления студентов-химиков о растворимости:
феноменография», Science Education, Vol. 80. С. 181-201.
Холмквист, М. (2011), «Учителя, обучающиеся в учебном исследовании», Instructional Science, Vol. 39
с. 497-511.
Holmqvist, M., Gustavsson, L. и Wernberg, A. (2008), «Теория вариаций: инструмент для улучшения образования
», в Kelly, AE and Lesh, R. (Eds), Handbook of Design Research Методы в
Образовании, Эрлбаум, Махва, Нью-Джерси, стр.111-30.
Кульберг А. (2010 г.), Чему учат и чему учат? Полученные профессиональные знания и
, которыми делятся учителя математики, Vol. 293, Acta Universitatis Gothoburgensis, Go
teborg.
Мартон Ф. и Бут С. (1997), Обучение и осведомленность, Лоуренс Эрлбаум Ассошиэйтс,
Махва, Нью-Джерси.
Мартон Ф. и Ло Л.М. (2007), «Обучение на основе обучающего исследования», Tidskrift fo
rla
rarutbildning
och forskning (Журнал педагогического образования и исследований), Vol. 14 No. 1.
14 No. 1.
Мартон Ф. и Моррис П. (2002), Что имеет значение? Обнаружение критических условий в классе
Обучение, Go
Этеборг Исследования в области педагогических наук 181, Acta Universitatis
Gothoburgensis, Go
teborg.
Мартон Ф. и Панг М.Ф. (2006), «О некоторых необходимых условиях обучения», Journal of the
Learning Sciences, Vol. 15 No. 2, pp. 193-220.
Мартон Ф. и Цуй А. Б. (2004), Классный дискурс и пространство обучения, Лоуренс
Эрлбаум, Махва, Нью-Джерси.
Прието Т., Бланко А. и Родригес А. (1989), «Идеи учащихся от 11 до 14 лет о природе решений
», Международный журнал естественнонаучного образования, том. 11. С. 451-63.
Рунессон, У. (2006), «Чему можно научиться? Об вариации как необходимом условии для обучения
», Scandinavian Journal of Educational Research, Vol. 50 No. 4, pp. 397-410.
Рунессон, У. и Густафссон, Л. (2010), «Изучение обучения — производство знаний для учителей?»,
Доклад, представленный на Международной конференции Всемирной ассоциации изучения уроков,
Бруней-Даруссалам, 9-10 декабря.
Vikstro
m, A. (2005), «Ett from
fo
rla
rande: en вариацииteoretisk studie av undervisning
och la
rande i grundskolans (Arande i grundskolans обучение: изучение теории вариаций
(преподавание и обучение по биологии) », докторская диссертация, Лулео
˚Технологический университет, Лулео
˚.
Дополнительная литература
Vikstro
¨m, A. (2008), «Что задумано, что реализовано и чему учатся? Преподавание и
изучение биологии в классе начальной школы », Journal of Science Teacher Education,
Vol.19, с. 211-33.
Об авторах
Анна Викстро
Ом, кандидат наук, старший преподаватель Лулео
˚Технологический университет. Анна Викстро
¨mis
автор-корреспондент, с ней можно связаться по адресу: [email protected]
Анна Бильстро
m преподает естественные науки в средней школе.
Парвиз Фазели преподает естественные науки в средней школе.
Моника Холм преподает естественные науки в средней школе.
Керстин Йонссон преподает естественные науки в средней школе.
Гунилла Карлссон преподает естественные науки в средней школе.
Питер Ридстро
Я преподает естественные науки в средней школе.
Чтобы приобрести оттиски этой статьи, напишите по электронной почте: [email protected]
Или посетите наш веб-сайт для получения дополнительной информации: www.emeraldinsight.com/reprints
40
IJLLS
2,1
Загружено от LULEA UNIVERSITY OF TECHNOLOGY at 05:27, 24 ноября 2014 г. (PT)
Как мы узнаем, что произошла химическая реакция? | Химические реакции
Обзор главы
1 неделя
Эта глава основывается на кратком введении в химические реакции, которое было рассмотрено в главе 1 (Атомы) Gr.8 Материя и материалы, особенно параграф Чистые вещества. Важный посыл этой главы заключается в том, что атомы перестраиваются в ходе химической реакции. Атомы не меняются, но то, как они расположены по отношению друг к другу, меняется. Это означает, что молекулы меняются, даже если количество атомов каждого типа, присутствующих в начале реакции, остается неизменным во всем. Чтобы помочь учащимся установить эту важную концептуальную связь, в этой главе используются диаграммы частиц, которые представляют некоторые реакции.Учащимся также будет предоставлена возможность самостоятельно нарисовать такие диаграммы в упражнениях и ответить на вопросы этой главы.
Атомы не меняются, но то, как они расположены по отношению друг к другу, меняется. Это означает, что молекулы меняются, даже если количество атомов каждого типа, присутствующих в начале реакции, остается неизменным во всем. Чтобы помочь учащимся установить эту важную концептуальную связь, в этой главе используются диаграммы частиц, которые представляют некоторые реакции.Учащимся также будет предоставлена возможность самостоятельно нарисовать такие диаграммы в упражнениях и ответить на вопросы этой главы.
Упражнение «Можем ли мы использовать химическую реакцию, чтобы заглянуть внутрь яйца?» Занимает несколько дней. Предлагается начать с него во время первого урока этой главы. Это поможет показать учащимся, что химические изменения обычно наблюдаются в макроскопическом масштабе и что макроскопические наблюдения предоставляют доказательства активности на уровне частиц.
Также неплохо подготовить известковую воду, необходимую для исследования «Можно ли использовать чистую известковую воду для обнаружения углекислого газа?», Прежде чем начинать эту главу. Чтобы сделать чистую известковую воду, следуйте инструкциям ниже:
Инструкции по приготовлению чистой известковой воды
Поместите несколько столовых ложек гидроксида кальция Ca (OH) 2 в прозрачную бутыль с реагентом на 500 мл и залейте водой.Встряхните или размешайте, чтобы получилась мутная суспензия.
Оставьте суспензию на несколько дней. Прозрачная жидкость над твердым Ca (OH) 2 представляет собой насыщенный раствор Ca (OH) 2 , также известный как чистая известковая вода.
Осторожно слейте столько, сколько вам нужно, не взбалтывая твердый осадок Ca (OH) 2 на дне.
Чтобы приготовить еще, просто добавьте еще воды, встряхните и дайте снова отстояться.Когда осадок полностью растворится, просто добавьте еще твердого Ca (OH) 2 .
3.1 Как мы узнаем, что произошла химическая реакция? (1,5 часа)
Задачи | Навыки | Рекомендация |
Деятельность: Разница между физическими и химическими изменениями | Доступ и вызов информации, сортировка и классификация, | Предлагается |
Задание: Можно ли с помощью химической реакции заглянуть внутрь яйца? | Наблюдение, запись информации, рисование и маркировка, интерпретация | CAPS рекомендуется |
3.2 Реагенты и продукты (1,5 часа)
Задачи | Навыки | Рекомендация |
Упражнение: Анализ эксперимента с яичной скорлупой | Интерпретация, объяснение химической реакции | Предлагается CAPS |
Деятельность: Изучение реакции ферментации | Получение и вызов информации, интерпретация | Дополнительно |
Активность: Некоторые химические реакции в жизни и жизни | Подкрепление, отзыв информации | CAPS рекомендуется |
Деятельность: Карьера в химии | Доступ к информации и ее вызов, исследование, чтение и письмо, общение | Дополнительно |
В предыдущей главе мы рассмотрели модель частиц материи и, в частности, изменения состояния.Вы помните, как нагревали и охлаждали воск свечи, чтобы наблюдать, как он тает, а затем затвердевает. Воск сначала превратился из твердого вещества в жидкость, а затем снова в твердое состояние. Это физических изменения. Химические свойства вещества не меняются.
Теперь мы посмотрим, что происходит, когда мы получаем химических изменений в веществах. Они происходят в ходе химических реакций.
Как мы узнаем, что произошла химическая реакция?
- химическая реакция Реакционная колба
- или реакционная емкость
Во время химической реакции одно или несколько веществ превращаются в новые.Вы знаете какие-нибудь химические реакции? Вы можете привести один или два примера?
Учащиеся могут помнить, что ржавление железа — это химическая реакция, или они могут привести в качестве примеров некоторые реакции из главы 1. Учащиеся также могут ссылаться на «изменение состояния» как на реакцию. Однако это НЕ химическая реакция или изменение. Объясните учащимся, что это просто физическое изменение, а не химическое изменение.
Как мы узнаем, что происходит химическая реакция? Какие признаки?
Предложите учащимся обсудить это в небольших группах в течение нескольких минут.Составьте список на доске всех их предложений, который может включать:
- Смесь может измениться и выглядеть иначе. (Каким образом? Может произойти изменение цвета и образование пузырьков или «кристаллов».)
- Возможен взрыв.
- Смесь может изменять температуру, нагреваясь или остывая. Это НЕ следует путать с физическими изменениями во время нагревания и охлаждения, например, когда вещество плавится или затвердевает.
Мы можем определить, произошла ли химическая реакция, когда произойдет одно или несколько из следующих событий:
В большинстве практических руководств по вводной химии перечисляются только три визуальные подсказки, указанные выше, как признаки того, что реакция имела место. Тем не менее, приведенные ниже невизуальные знаки тоже заслуживают внимания.
Все вышеперечисленные знаки являются визуальными или фиксируются визуально.Значит, мы можем их видеть. Другие наши органы чувств также могут помочь нам определить, произошла ли химическая реакция:
- Иногда можно почувствовать запах химических изменений, например, когда образуется новый материал с сильным запахом.
- Могут ощущаться другие химические изменения, например, когда в результате реакции выделяется тепло.
- Слышны некоторые химические изменения, например когда происходит взрыв.
Видео о физических и химических изменениях.
Это короткое задание, чтобы убедиться, что учащиеся понимают разницу между химическими и физическими изменениями, и использует примеры из повседневной жизни.
ИНСТРУКЦИЯ:
Ниже представлена таблица, в которой перечислены некоторые химические и физические изменения.
Вам нужно решить, является ли изменение физическим или химическим, и записать ответ в последний столбец.
Изменение | Это физическое или химическое изменение? |
Нарезка картофеля кубиками | |
Кипяток в кастрюле на плите | |
Яичница на сковороде | |
Белки для взбивания | |
Растворение сахара в воде | |
Горящий газ в газовой плите | |
Ваше мороженое тает на солнце | |
Молоко скисает | |
Железные ворота снаружи ржавчины |
Вот ответы.Учащимся нужно только указать физический или химический состав — некоторые объяснения были предоставлены в качестве основы для учителя и, если вы хотите, объяснить изменения своим ученикам.
Изменение | Это физическое или химическое изменение? |
Нарезка картофеля кубиками | Физический |
Кипяток в кастрюле на плите | Физический |
Яичница на сковороде | Химический (яичные белки подвергаются химическому изменению и сшиваются, образуя сеть) |
Белки для взбивания | Физический (воздух нагнетается в жидкость, но новое вещество не образуется) |
Растворение сахара в воде | Физический (зерна сахара диспергированы в воде, но отдельные молекулы сахара не изменяются) |
Горящий газ в газовой плите | Химические вещества (водяной пар и углекислый газ) |
Ваше мороженое тает на солнце | Физический |
Молоко скисает | Химическая (производится молочная кислота) |
Железные ворота снаружи ржавчины | Химический (формы оксида железа — более подробно об этом пойдет речь в Гр.9) |
Теперь мы применим наш контрольный список на практике, посмотрев на реакцию, достаточно безопасную, чтобы попробовать дома. Вы когда-нибудь задумывались, как будет выглядеть сырое яйцо без скорлупы? Мы собираемся использовать химическую реакцию, чтобы удалить скорлупу с яйца, не разбивая его!
Как сделать так, чтобы яйцо выглядело так? http: // www.flickr.com/photos/gemsling/2687069763/Начните с этого занятия как можно скорее, потому что для полного растворения яичной скорлупы требуется несколько дней. Возможно, стоит провести реакцию в двух экземплярах, если в эксперименте что-то пойдет не так. Яйцо без скорлупы очень нежное и может разбиться, и тогда было бы неплохо иметь «запасное» яйцо.
Видео об эксперименте с голым яйцом
МАТЕРИАЛЫ:
- яйца
- стакан
- белый уксус
ИНСТРУКЦИЯ:
Осторожно поместите яйцо в стакан.Будьте осторожны, чтобы не треснуть скорлупу.
Залейте яйцо уксусом. Подождите несколько минут. Вы видите, что что-то происходит на поверхности яичной скорлупы?
- Напишите свои наблюдения ниже.
- О чем свидетельствует это наблюдение?
- Яичная скорлупа постепенно покрывается пузырями.
Пузырьки — признак протекающей химической реакции.
Оставьте яйцо в уксусе на 4-5 дней. После этого вы должны завершить оставшуюся часть упражнения.
Примечание: Может потребоваться долить уксус, если реакция начинает замедляться.Не забудьте вернуться к занятиям в конце недели, когда яичная скорлупа полностью растворится.
Через 4–5 дней посмотрите на яйцо в уксусе и запишите свои наблюдения.На уксусе плывет пенистый коричневый слой.
Осторожно выньте яйцо из уксуса большой ложкой.Коснитесь поверхности яйца. Напишите свои наблюдения ниже. Что случилось с оболочкой?
Яйцо на ощупь мягкое и шаткое. Оболочка исчезла, потому что она растворилась. На его месте порошковое покрытие.
Сотрите с яйца порошкообразный налет и поместите его в немного чистой воды.Как это выглядит сейчас?Яйцо потеряло скорлупу, и мы видим внутри яичный белок и желток.
Нарисуйте и обозначьте изображения того, как выглядело содержимое стакана до и после реакции.Учащиеся должны нарисовать изображения эксперимента в начале и в конце.На первом фото должно быть целое яйцо в стакане, залитое прозрачным жидким уксусом. На втором изображении должно быть показано прозрачное яйцо с четко обозначенными белками и желтком, погруженное в прозрачный жидкий уксус с плавающим сверху коричневым слоем.
ВОПРОСЫ:
Какие признаки вы увидели, говорящие о химической реакции?Яйцо выглядит иначе.Мы также видели пузыри на яичной скорлупе, а затем поверх уксуса плавал пенистый, липкий слой.
Напишите короткий абзац, чтобы объяснить, что случилось с яичной скорлупой.Абзац учащегося должен содержать как минимум следующие идеи:
- Яичная скорлупа прореагировала с уксусом и была «съедена».
- Яичная скорлупа растворяется в уксусе.
- Материал яичной скорлупы подвергся химическому изменению. Их заменили на другие материалы.
Кости, зубы и жемчуг растворятся в уксусе, как и яичная скорлупа, хотя это может занять гораздо больше времени.
Как можно превратить одно соединение в другое? Что происходит с частицами, когда соединения вступают в реакцию? В следующем разделе мы ответим на эти вопросы.
Реагенты и продукты
- реагент
- товар
- химическое уравнение
- коэффициенты
- ферментация
В главе 1 мы узнали, что соединения образуются в результате химических реакций.Вы можете вспомнить, что такое соединение? Напишите здесь определение.
Соединение — это материал, состоящий из атомов двух или более элементов, которые химически связаны вместе в фиксированном соотношении. Поощряйте учащихся записывать это на полях своей рабочей тетради.
Запишите формулы трех различных соединений.
Ответ, зависящий от учащегося.H 2 O, CO 2 , NaCl и т. Д.
При активности яичной скорлупы карбонат кальция в яичной скорлупе вступил в реакцию с уксусной кислотой и образовал ацетат кальция, диоксид углерода и воду.
Мы можем записать это химическое уравнение следующим образом:
яичная скорлупа + уксус → ацетат кальция + углекислый газ + вода
ВОПРОСЫ:
Есть два исходных вещества до , происходит эта химическая реакция.Кто они такие?
Яичная скорлупа (карбонат кальция) и уксус (уксусная кислота).
После реакции присутствуют три вещества. . Что это?
Это ацетат кальция, диоксид углерода и вода.
Каковы химические формулы соединений воды и углекислого газа?Вода — это H 2 O, а диоксид углерода — CO 2 .
Мы называем вещества, которые присутствуют до того, как произошла химическая реакция, реагентами .Каковы реагенты эксперимента с яичной скорлупой?
Яичная скорлупа (карбонат кальция) и уксус (уксусная кислота).
Как вы думаете, что произошло с реагентами во время химических реакций?Используйте это, чтобы оценить уровень понимания учащимся.Они должны упомянуть, что реагенты используются для изготовления продуктов.
Мы называем вещества, которые образуются в ходе химической реакции, продуктами . Каковы результаты эксперимента с яичной скорлупой?
Это ацетат кальция, диоксид углерода и вода.
Во время химической реакции реагенты используются для производства продуктов. Атомы в реагентах были перегруппированы в новые соединения (продукты).
Химическая реакция — это перегруппировка атомов
Попросите ваших учеников проделать эти реакции сами на своих партах перед ними, используя бусинки / горошек / чечевицу / шарики, и перегруппируйте атомы, чтобы получить продукты.
Чтобы преобразовать соединение в другое соединение, нам нужно изменить способ расположения атомов в соединении. Именно это и есть химическая реакция: перегруппировка атомов с целью превращения одного или нескольких соединений в новые соединения.
Каждый раз, когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция.
Мы собираемся использовать цветные кружки для обозначения атомов в соединениях, которые происходят в химических реакциях.Если у вас остались прежние бусинки или пластилин, вы также можете сами провести эти реакции на своем столе. Взгляните на следующую диаграмму.
Углерод и кислород слева от стрелки реагируют с образованием углекислого газа справа от стрелки.
Слева от стрелки у нас есть ситуация «до». Эта сторона представляет вещества, которые у нас есть до реакции. Их называют реагентами .
Справа от стрелки — ситуация «после». Эта сторона представляет вещества, которые у нас есть после того, как реакция произошла. Их называют товаров.
РЕАКТИВЫ (до реакции) → ПРОДУКТЫ (после реакции)
Вы видите, как атомы перегруппировались? Это означает, что произошла химическая реакция. Обозначьте диаграмму «реагентами» и «продуктом».
Реакция между углеродом и кислородом происходит, когда мы сжигаем уголь. Уголь — это углерод, и когда он горит в кислороде, образуется углекислый газ.
Горящий уголь. http://www.flickr.com/photos/cote/66570391/На схеме ниже представлена другая химическая реакция. Кислород (красные молекулы) реагирует с водородом (белая молекула) с образованием воды.
Какие реагенты в этой реакции?
Какой продукт в этой реакции?
Как вы думаете, почему водород и кислород представлены как два соединенных атома?
Это ссылка на то, что учащиеся рассмотрели в главе 1 о двухатомных молекулах.Эти элементы существуют в виде двухатомных молекул, поэтому в них два атома соединены вместе.
Вы помните, когда мы говорили о химических связях между атомами в молекуле в главе 1? Химическая связь — это сила, удерживающая атомы вместе. Следовательно, во время химической реакции связи между атомами должны разорваться, чтобы атомы могли перегруппироваться с образованием продуктов. Между атомами продукта образуются новые связи.
Далее мы рассмотрим химическую реакцию, которая использовалась человечеством на протяжении веков.
Ферментация — это химическая реакция
Вы когда-нибудь забывали немного молока или сока в бутылке и обнаруживали, что через несколько дней они «исчезли»? Если вы случайно его попробовали, возможно, он был кислым, а в случае сока — немного шипучим. Ваши чувства могли предупредить вас, чтобы вы больше не пили его. Вы помните обучение на гр. 7 что наше чувство вкуса защищает нас от испорченной пищи?
Кислый вкус молока или сока вызван продуктами брожения .Какие соединения имеют кислый вкус?
Ферментация не только производит нежелательные продукты. Йогурт, пахта и сыр — это кисломолочные продукты. В этих примерах в процессе ферментации образуются кислоты, которые придают этим продуктам кислый вкус.
Различные молочные продукты, приготовленные методом ферментации.Ферментация — это также процесс, с помощью которого для производства алкоголя можно использовать различные фрукты, овощи и злаки.Во многих культурах приготовление алкогольных напитков является частью их традиционных знаний.
Два ведра имбирного пива для брожения. http://www.flickr.com/photos/nikonvscanon/4231775258/Как работает ферментация
Видео о том, как работает ферментация (5:39), короткое и веселое. Первые две минуты дают краткое описание. В оставшейся части видео ведущий демонстрирует, как самому сделать имбирное пиво.
Базовую реакцию в процессе ферментации можно резюмировать следующим образом:
глюкоза → спирт + диоксид углерода
Какие реагенты и продукты в этой реакции?
Глюкоза — реагент, спирт и углекислый газ — продукты.
Мы можем изобразить молекулы, чтобы показать, как атомы перестраиваются во время реакции:
На приведенной выше диаграмме серые атомы представляют собой углерод (C), красные атомы — кислород (O), а маленькие белые — водород (H). Запишите названия соединений, участвующих в этой реакции.
Учащиеся должны написать слева глюкоза, а справа — алкоголь, а затем диоксид углерода.
Сама по себе глюкоза не превращается в спирт и углекислый газ! Микроорганизмы, такие как дрожжи и бактерии, активно сбраживают глюкозу.
Дрожжи производят специальные химические вещества, называемые ферментами, которые могут разрушать связи в сахарах, таких как глюкоза, с образованием более мелких молекул, таких как спирт и углекислый газ.
Учащиеся впервые столкнулись бы с бактериями в Gr.7 Life and Living при изучении биоразнообразия и классификации организмов. Более подробно они рассмотрят микроорганизмы в гр. 9 Жизнь и жизнь.
В Южной Африке популярным напитком является имбирное или ананасовое пиво! Шипучие пузырьки в имбирном или ананасовом пиве — это пузырьки углекислого газа, вырабатываемые дрожжами во время брожения. Сделаем имбирное пиво!
Это дополнительное задание, которое можно выполнить, если у вас есть время в классе.Также может быть выполнен как проект . В следующем семестре мы еще раз рассмотрим ферментацию в «Материи и материалах». При ферментации глюкоза не полностью расщепляется, поэтому она выделяет меньше энергии (в форме АТФ), чем при дыхании. Ферментация также является анаэробной, что означает, что она не требует кислорода, тогда как дыхание требует кислорода. При брожении образуется спирт. Однако имбирное пиво безалкогольное . Хотя его называют пивом, оно не является алкогольным, потому что оно не ферментируется достаточно долго.
ИНСТРУКЦИЯ:
- Вам нужно изучить, как приготовить традиционное южноафриканское имбирное пиво.
- Определите, какие ингредиенты вам понадобятся.
- Как только вы это сделаете, вы можете всем классом выбрать лучший рецепт, который вы будете использовать. Затем вы можете варить имбирное пиво в классе со своим учителем.
- Ответьте на следующие вопросы.
Здесь можно найти рецепт имбирного пива. Учащийся также должен изучить свой собственный рецепт в группах и написать лучший рецепт, который у них есть. Затем вы можете либо выбрать один из их рецептов, либо использовать этот, либо вы можете протестировать разные рецепты, чтобы увидеть, какой из них работает лучше всего.
Пошаговое руководство по приготовлению имбирного пива. http://whatsforsupper-juno.blogspot.com/2007/06/old-fashioned-home-made-ginger-beer.html
МАТЕРИАЛЫ:
- 6-8 лимонов среднего размера
- цедра 2 лимонов тертая
- 250 мл (1 стакан) свежевыжатого лимонного сока (примерно из 6 лимонов)
- 2 кусочка свежего имбиря размером с большой палец
- 2 чайные ложки сухого порошка имбиря
- 6 изюмов
- 750 мл (3 стакана) белого сахара
- 5 литров воды
- 1 пакетик по 10 г быстрорастворимых (сухих) дрожжей
- терка
- соковыжималка для лимона
- контейнер или ведро
- ложка деревянная
- большая бутылка
- несколько бутылок меньшего размера с крышками
- воздушные шары
- резинки
ИНСТРУКЦИЯ:
- Натереть цедру 2 лимонов на терке в большую емкость или ведро.
- Натереть и свежий имбирь крупными зубцами терки.
- Выжмите сок примерно из 6 лимонов. Вам понадобится 250 мл. Добавьте в смесь сок.
- Добавьте сушеный имбирь, изюм и сахар.
- Добавьте 1 литр горячей воды (не до кипения) и перемешивайте около 3 минут, пока сахар полностью не растворится.
- Добавьте еще 4 литра теплой воды.Убедитесь, что вода достаточно прохладная, чтобы вам было удобно держать в ней палец (иначе дрожжи погибнут!).
- Вылейте пакетик сухих дрожжей поверх воды и оставьте на несколько минут.
- Все перемешать деревянной ложкой.
- Налейте жидкость в большую бутылку и прикрепите баллон к горлышку бутылки. Закрепите баллон на шее толстой резинкой.
- Поставьте флакон в теплое место, но не под прямыми солнечными лучами.
- Дать постоять примерно 4 — 5 часов.
- Когда изюм поднимется вверх, имбирное пиво готово к употреблению.
- Процедить жидкость через сито. Убедитесь, что вы работаете над раковиной или подобным местом.
- Разлейте имбирное пиво в чистые прозрачные стеклянные бутылки и добавьте изюм в каждую бутылку. Убедитесь, что вы не наполняете бутылки полностью, а оставьте не менее 7-10 см между жидкостью и горлышком бутылки.
- Прикрепите баллон к горлышкам половины бутылок и закрепите их резиновыми лентами.
- Наверните крышки на другую половину бутылок.
- Храните бутылки вдали от источников тепла и солнечного света. (Необязательно находиться в теплом месте.)
- Оставьте на ночь не менее 8 часов.
- Аккуратно откручиваем колпачки. Газ внутри захочет уйти, поэтому делайте это медленно и осторожно.
ВОПРОСЫ:
Каковы реагенты при приготовлении имбирного пива?Химическая реакция происходит между сахаром и ферментирующими фруктами и дрожжами. Итак, реагентами являются сахар и фрукты (имбирь и изюм).
Каков продукт реакции, происходящей в имбирном пиве?Продукт — двуокись углерода (и очень небольшое количество спирта).
Почему в имбирном пиве появляются пузырьки?Это углекислый газ, задержанный в жидкости.
Как вы думаете, откуда взялся газ?Это результат химической реакции между дрожжами, сахаром и ферментирующими фруктами.
Другой пример того, как происходит химическая реакция, — это когда мы сжигаем дрова в огне дома или для приготовления пищи.Дерево горит и выделяет углекислый газ и водяной пар. Каковы продукты и реагенты в этих реакциях?Реагентами являются древесина и кислород, а продуктами — диоксид углерода и вода.
Химические реакции могут помочь нам обнаружить определенные вещества
Некоторые химические реакции могут дать уникальные и даже впечатляющие результаты! Вы когда-нибудь видели эксперимент с вулканом? Этот эксперимент показан по ссылке на видео в окне посещения.
Видео, показывающее вулкан из дихромата аммония
Когда дихромат аммония горит в кислороде, в результате реакции образуются ярко-оранжевые искры. В результате реакции образуются газообразный азот (N 2 ), вода и темно-зеленое соединение, называемое оксидом хрома, в качестве продуктов. Эта реакция уникальна. Только дихромат аммония вступает в реакцию с кислородом, образуя именно эти продукты с такими визуальными эффектами.
Дихромат аммония до его сжигания в кислороде. Оксид хрома является продуктом.Когда два вещества реагируют уникальным и характерным образом при смешивании, одно из них может быть использовано для обнаружения другого.
Это упражнение укрепляет некоторые концепции дыхания и фотосинтеза, полученные в начале года из «Жизни и жизни».CAPS предлагает повторить эксперимент, надувая пузыри через известковую воду. Мы сделали это в главе 1 в этом году в качестве упражнения, но вы можете кратко повторить это здесь, чтобы снова показать результаты, если учащиеся плохо его помнят.
Вы помните, что в главе 1 книги «Жизнь и жизнь» мы использовали чистую известковую воду для обнаружения углекислого газа в дыхании? Какого цвета стала прозрачная известковая вода, когда мы пустили через нее пузыри?
Получился молочно-белого цвета.
Известковая вода — это раствор гидроксида кальция в воде. Между известковой водой и углекислым газом происходит реакция с образованием белого вещества в воде, называемого карбонатом кальция. Какие реагенты и продукты в этой реакции?Реагентами являются известковая вода (гидроксид кальция) и диоксид углерода, а продуктами являются карбонат кальция и вода.
Мы говорим, что использовали изменение цвета известковой воды, чтобы обнаружить углекислый газ в нашем дыхании. Двуокись углерода является побочным продуктом химической реакции, протекающей во время дыхания у всех организмов. Напишите словесное уравнение для дыхания.глюкоза + кислород → энергия + углекислый газ + вода
В «Жизнь и жизнь» мы говорили об ингредиентах дыхания, поскольку еще не выучили термины «реагент» и «продукт».Каковы реагенты и продукты дыхания?Реагенты — глюкоза и кислород. Продуктами являются энергия, углекислый газ и вода.
Каковы реагенты и продукты фотосинтеза?Реагенты — диоксид углерода и вода, продукты — глюкоза и кислород.
Мы также узнали, что химические реакции — это просто перегруппировки атомов в молекулах с образованием разных молекул. Этим зарабатывают на жизнь многие химики! Они находят способы перегруппировки атомов, чтобы создавать новые соединения.
Карьера по химии
Этот раздел не предназначен для оценки, и вы можете его пропустить.Тем не менее, мы настоятельно рекомендуем вам дать своим ученикам возможность открыть для себя применение того, что они изучают в классе, в окружающем их мире, даже если это будет домашнее задание. Для учащихся очень важно понимать, что то, чему они учатся в классе, выходит далеко за пределы вашего класса. Поощряйте их любопытство!
Естественные науки — это открытия! Мы хотим показать вам, как то, что вы изучаете в классе, полезно в реальном мире.Этот предмет слишком велик для нас, чтобы изучать его все в школе. Вы можете выбрать множество профессий, основанных на науке. Интересуйтесь окружающим миром и исследуйте его с помощью растущих научных знаний!
В следующем году вы выберете предметы, которые вы будете изучать до 12 класса. Выберете ли вы физические науки, науки о жизни и математику? Прежде чем вы решите, какие предметы выбрать, подумайте, что вы можете делать с каждым из них после школы.
Давайте узнаем немного больше о возможностях областей, связанных с тем, что мы изучали в Matter and Materials.
Мария Кюри (1867-1934) была известным химиком и физиком, получившим особую награду за свои исследования в области радиоактивности. Она была первой женщиной, получившей Нобелевскую премию, единственной женщиной, выигравшей в двух областях, и единственным человеком, который еще не получил Нобелевскую премию в нескольких науках!Многие учащиеся могут задаться вопросом, в чем разница между химиком и инженером-химиком?
A Химик изучает состав и свойства вещества.Они используют полученные знания для разработки новых соединений, продуктов и процессов, улучшающих нашу повседневную жизнь. Химик требует обширных знаний в области химии и компетентности в лаборатории. Химики часто исследуют химические реакции, чтобы получить новые материалы и соединения. Это могут быть новые лекарства, инновационные строительные материалы, новые виды топлива, не наносящие вреда окружающей среде, и многое другое. Исследование новых химических реакций сложно. Работа часто исследуется в группах с другими учеными и инженерами.
A Инженер-химик обычно участвует в разработке способов производства новых соединений, разработанных химиками в больших масштабах, или в поиске способов снижения стоимости производства этих соединений. Инженеру-химику нужны общие знания в области химии, но также необходимо много знать о процессах и о том, что ими движет.
Исследователь работает над открытием чего-то нового или нового способа ведения дел, в то время как инженер оптимизирует известный процесс или выясняет, как лучше всего получить известное соединение.
Пригласите химика / инженера: Вы знаете кого-нибудь, кто химик или инженер-химик? Возможно, вы живете недалеко от университета? Если да, то можете пригласить химика или инженера в школу и рассказать классу о работе, которую делают химики. Кроме того, вы можете посетить химика или инженера на их рабочем месте и попросить их показать вам все вокруг. Вы можете попросить своих учеников заранее подготовить несколько вопросов: вы можете спросить их об их работе, их обучении и о том, какие качества, по их мнению, необходимы, если кто-то хочет стать химиком.Просто не забудьте сначала записаться на прием! Это мероприятие можно превратить в небольшой групповой проект. Учащихся могут попросить написать краткий отчет о собранной информации. Это не для целей оценки.
Существует множество применений и применений химии, и многие люди в разных профессиях тем или иным образом используют химию. Давай выясним.
ИНСТРУКЦИЯ:
- Ниже приведен список различных профессий, в которых все так или иначе используют химию.Просмотрите список, а затем выберите пять профессий, которые вам интересны.
- Поищите в Интернете, что представляет собой каждая профессия.
- Напишите описание своей карьеры в одну строку.
- Если есть карьера, которая вас действительно интересует, нарисуйте рядом смайлик и обязательно прочитайте дополнительную информацию по теме и о том, куда химия может вас привести! Узнайте, какой уровень химии вам понадобится для этой конкретной карьеры.
- Есть много других профессий, помимо перечисленных здесь, в которых каким-либо образом используется химия, поэтому, если вы знаете что-то еще, что не указано здесь и это вас интересует, следуйте своему любопытству и откройте для себя возможности!
Некоторые профессии, связанные с химией:
- Агрохимия
- Биохимия
- Биотехнологии
- Химическое образование / преподавание
- Химик-исследователь
- Химия окружающей среды
- Судебная медицина
- Пищевая наука и технологии
- Генетик
- Геохимия
- Материаловедение
- Медицина и медицинская химия
- Нефтяная и нефтяная промышленность
- Органическая химия
- Океанография
- Патентный закон
- Фармацевтические препараты
- Освоение космоса
- Зоология
Описание интересующих Вас профессий:
Научные игры для 8-х классов для вашего класса
Преподавание естественных наук в 8-м классе — непростая задача.Множество отвлекающих факторов, неудобные социальные вопросы и откровенный пессимизм бросают вызов лучшим учителям. Не бойся!
Вы можете создать веселую, увлекательную и продуктивную учебную среду с научными играми Legends of Learning. Получите доступ к более чем 800 онлайн-играм, предназначенным для средней школы, Земля и космос, жизнь и физические науки сегодня!
Research демонстрирует, что наши научные игры для 7-х классов привлекают учащихся, помогая им усваивать уроки и лучше выполнять тесты.
Наши игры соответствуют стандартам NGSS и поддерживают некоторые государственные стандарты, включая GSE, SOL и TEKS.Лучше всего, что все они проверены учителями!
Примите участие в наших научных играх для 8-х классов
В дополнение к более чем 800 научным играм, наше предложение для средней школы позволяет вашим классным урокам взлететь с тысячами тестовых заданий и выбрать симуляции PhET. Эти предложения разбиты на три основные предметные области:
Игры по наукам о Земле и космосе
Игры по наукам о жизни
Игры по физическим наукам
В каждой предметной области вы найдете 25-35 учебных целей (или уроков).В целях обучения наукам о Земле и космосе также предусмотрены планы уроков, которые включают занятия по наукам о Земле. Эти ресурсы доступны через слайдер выше на этой странице.
Каждая учебная цель средней школы включает от 7 до 10 игр, причем игра с наивысшим рейтингом учителей находится наверху. Игры также показывают студенческие отзывы.
Упрощение использования научных игр для учителей
Сорок четыре ученика средней школы из школьного округа округа Кобб в Джорджии присоединились к Legends of Learning 21 августа во время производственной поездки в Клемсон, штат С.C., чтобы увидеть солнечное затмение 2017 года. Кристен Крейн, одна из учителей в поездке, рассказывает, как прошел этот опыт, в том числе о том, как игры Legends of Learning помогли подготовить учеников.
Попробовать легенды обучения легко. Игры бесплатны для учителей, которые хотят создать бесплатную учетную запись. Нет необходимости добавлять личную финансовую информацию.
Вперед, убедитесь сами. Просмотрите нашу библиотеку сегодня!
Естественные науки 8 класс
Есть только два класса чистых веществ, а именно элементов и соединений .Чтобы понять разницу между ними, взгляните на две диаграммы ниже.
На диаграмме слева представлен элемент. Вы видите, что все атомы одного вида? Элемент — это материал, состоящий из атомов только одного вида.
Теперь посмотрите на диаграмму справа, представляющую комплекс. На этой диаграмме показаны две важные особенности соединений:
Соединение — это материал, состоящий из двух или более атомов, которые химически связаны друг с другом.
Теперь мы рассмотрим каждый из этих классов отдельно и обсудим несколько примеров каждого из них.
Элементы
Мы только что узнали, что элемент состоит из атомов одного вида. Это означает, что если бы у нас был кусок металлической меди, он бы полностью состоял из атомов меди. Точно так же кусок серебра полностью состоит из атомов серебра. Медь и серебро выглядят по-разному и имеют разные свойства, потому что они состоят из разных атомов.Взгляните на следующую таблицу, которая иллюстрирует субмикроскопическое изображение атомов, а также ювелирное изделие, сделанное из каждого из различных металлов.
ВОПРОСЫ:
Почему атомы серебра больше, чем атомы меди на предыдущих диаграммах? Подсказка: найдите два элемента в Периодической таблице и сравните их положение.Серебро находится ниже меди в Периодической таблице, что означает, что атомы серебра больше, чем атомы меди.
Считаете ли вы, что вещество, представленное на следующей диаграмме, является элементом? Чтобы помочь вам ответить на вопрос, просмотрите вопросы под диаграммой.
Сначала запишите то, что вы видите на картинке.Учащиеся могут сказать, что видят пары атомов, слипшихся вместе.
Грозди плотно упакованы или далеко друг от друга?Они относительно далеко друг от друга.
Что это обозначает? Как вы думаете, вещество — твердое, жидкое или газообразное?
Как вы думаете, это смесь веществ или чистое вещество? Почему вы так думаете?Это чистое вещество, потому что все молекулы выглядят одинаково.
Все ли атомы одного вида?
Какой класс веществ состоит из атомов только одного вида?
Является ли вещество элементом? Почему?Вещество является элементом, потому что оно состоит только из одного вида атома.
Примечание: На самом деле это двухатомные элементы, такие как кислород (O 2 ), азот (N 2 ), водород (H 2 ), которые существуют в виде двухатомных (двухатомных) молекул при комнатной температуре. .
Могут ли элементы состоять из молекул?
Не важно, чтобы учащиеся ответили на этот вопрос; он предназначен для введения понятия, что оба элемента И соединения могут существовать как молекулы, но что молекулы элементов фундаментально отличаются от молекул соединений.
Кластеры атомов в предыдущем примере называются молекулами. Молекула — очень важное слово в химии. Молекула — это два или более атома, которые химически связаны друг с другом.
Атомы в молекуле могут быть одного типа (в этом случае это может быть молекула элемента) или они могут быть разных типов (в этом случае это может быть молекула соединения).
Не все элементы имеют молекулы. Металлы в левой и средней части Периодической таблицы представляют собой твердые тела при комнатной температуре, поэтому они существуют в виде плотно упакованных массивов атомов, как в предыдущих примерах серебра и меди.
Многие неметаллы в правой части Периодической таблицы представляют собой газы при комнатной температуре, которые существуют в виде молекул, состоящих из двух атомов каждая.Их называют двухатомными молекулами . Изображение элемента, которое мы обсуждали ранее, показывает, как выглядят двухатомные молекулы. Кислород (O 2 ), азот (N 2 ), водород (H 2 ), хлор (Cl 2 ) и некоторые другие элементы из неметаллов — все они образуют двухатомные молекулы.
Нарисуйте изображение одной из этих двухатомных молекул в пространстве ниже.
Учащиеся должны нарисовать два соединенных друг с другом круга одинакового размера и цвета.Предлагается научить учащихся создавать некоторые из двухатомных молекул с помощью бусинок, шариков из пластилина и т. Д. Убедитесь, что они знают, что бусинки теперь представляют собой целые атомы, а не субатомные частицы.
Двухатомный относится к молекуле, состоящей из двух одинаковых атомов, связанных вместе, как в кислороде (O 2 ). «Ди» означает два. Трехатомный относится к молекуле, состоящей из трех одинаковых атомов, связанных вместе, как озон (O 3 ).
Это краткий обзор того, что учащиеся только что узнали об атомах и молекулах, и возможность их различать.
Давайте убедимся, что мы понимаем разницу между атомами и молекулами.
ВОПРОСЫ:
Посмотрите на следующие схемы. Решите, представляет ли каждый атом атом или молекулу. Если это молекула, укажите, сколько атомов составляет молекула.
Диаграмма | Атом или молекула? |
Атом | |
Молекула из 2 атомов | |
Молекула из 15 атомов03 | |
Молекула из 9 атомов |
Посмотрите на следующую сложную молекулу.
Сколько атомов состоит в этой молекуле?
Сколько различных типов атомов состоит в этой молекуле?В состав этой молекулы входят 3 различных типа атомов.
Что удерживает атомы вместе в этой молекуле?Между атомами существуют химические связи.
Теперь давайте подумаем об этом: если соединения состоят из двух или более видов атомов, это будет означать, что соединения состоят из двух или более различных элементов, которые объединились.
Соединения
По мере того, как вы просматриваете этот материал, предложите учащимся создавать свои собственные молекулы, используя бусинки или пластилин на столе перед ними.
В известной нам вселенной как минимум 118 элементов. Они могут образовывать соединения, связываясь в миллионы различных комбинаций — слишком много, чтобы обсуждать здесь! Мы рассмотрим несколько простых комбинаций элементов, чтобы проиллюстрировать идею.
Поскольку вода является таким важным компонентом для организмов, живущих на Земле, мы будем использовать это в качестве нашего первого примера.Ученые знают, что молекула воды состоит из одного атома кислорода и двух атомов водорода. Если бы мы могли их видеть, все молекулы воды были бы немного похожи на эту диаграмму молекулы воды.
Представление молекулы воды.Международный союз теоретической и прикладной химии (IUPAC) называет воду монооксидом дигидрогена.
Все молекулы воды абсолютно одинаковы. Мы говорим, что атомы связаны в фиксированном соотношении : два атома водорода на каждый атом кислорода.Атомы в молекуле удерживаются вместе особой силой, которую мы называем «химическая связь , ».
Эти связи известны как ковалентные связи, но учащиеся пока не обязаны это знать. Вы также можете напомнить учащимся на этом этапе, что диаграммы молекул — это просто представления, и мы используем разные цвета, чтобы различать атомы разных элементов. Атомы кислорода на самом деле не красные.
Химические формулы
Можете ли вы вспомнить, что у каждого элемента есть свой уникальный химический символ? Мы можем объединить эти символы в химическую формулу воды.Химическая формула — еще одно очень важное понятие в химии.
Химическая формула воды: H 2 O. Она показывает отношение атомов водорода (два) к атомам кислорода (один) в одной молекуле воды. Как вы думаете, о чем нам говорит химическая формула CO 2 ?
Он говорит нам, что один атом углерода (C) связан с двумя атомами кислорода (O) в CO 2 . На этом этапе предлагается написать несколько химических формул на доске и попросить учащихся объяснить вам, что каждый из них говорит вам.Попросите учащихся делать заметки на боковых полях своих рабочих тетрадей, пока вы обсуждаете это в классе. Это послужит введением к следующему занятию. Например, вы также можете написать:
H 2 для газообразного водорода, что означает, что два атома водорода связаны вместе. Это двухатомная молекула.
- NaCl для хлорида натрия (поваренная соль), что означает, что один атом натрия связан с одним атомом хлора.
KMnO4 — перманганат калия.Это может быть немного сложнее, но подчеркивает, что молекула может состоять более чем из двух разных элементов. Здесь один калий, один марганец, один атом азота и четыре атома кислорода связаны вместе, образуя одну молекулу.
В следующем упражнении мы попрактикуемся в написании и понимании химических формул. Всегда полезно думать о новой концепции разными способами. По этой причине мы также будем строить модели молекул, для которых пишем формулы.
МАТЕРИАЛЫ:
- Пластилин или пластилин разных цветов
ИНСТРУКЦИЯ:
- В следующей таблице названия некоторых чистых веществ приведены в левом столбце. Заполните все пустые блоки в таблице.
- Постройте модель одной молекулы каждого соединения на столе. Ваши атомы должны быть размером с горошину. Это может помочь вам построить модель, прежде чем рисовать молекулу в правом столбце.Когда вы закончите, покажите своему учителю.
Чтобы помочь вам в этом, вот несколько рекомендаций:
- Каждая строка в таблице содержит достаточно информации, чтобы вы могли заполнить все пустые блоки.
- Первая строка заполнена за вас, поэтому у вас есть пример:
- В графе 1 указано название: вода
Колонка 2 содержит формулу: H 2 O
Столбец 3: Формула воды (в столбце 2) содержит всю информацию, необходимую для заполнения блока в «Из чего он сделан?» столбец.Когда мы читаем формулу H 2 O, нижний индекс «2» говорит нам, что существует два атома H. Поскольку у O нет нижнего индекса, это означает, что существует только один атом O.
- Колонка 4: Модель молекулы воды должна отражать наличие одного атома О и двух атомов Н. Откуда мы знаем, что О должен быть посередине? На данный момент достаточно знать, что атом, которого у нас меньше всего, обычно находится посередине.
На этом этапе не важно, чтобы учащиеся получали точные углы между атомами, например, угол между атомами водорода в молекуле воды, поскольку они узнают только о том, что влияет на это позже, в Gr.10-12.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? |
Вода | H 2 O | Два атома H и один атом O | |
Углекислый газ03 | CO 2|||
Диоксид серы | |||
Сероводород | H 2 S | ||
Аммиак | Один атом N и три атома H | ||
Газообразный кислород | Два атома O | ||
Газообразный азот | N 2 | ||
Газообразный хлор | |||
Водородный газ | Два атома H |
Заполненная таблица должна выглядеть следующим образом.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? | |||
Вода | H 2 O | Два атома H и один атом O | ||||
Углекислый газ03 | CO Два атома O и один атом C||||||
Диоксид серы | SO 2 | Два атома O и один атом S | водород | |||
| 2 сероводород H 2 S | Два атома H и один атом S | |||||
Аммиак | NH 3 | Один атом N10 903 903 903 903 | Газообразный кислород | O 2 | Два атома O | 90 315 |
Газообразный азот | N 2 | Два атома азота | ||||
Газообразный хлор | Cl | |||||
Водородный газ | H 2 | Два атома H |
ВОПРОСЫ:
Перечислите все вещества из таблицы, которые являются элементами.Напишите их имена и формулы.Водород, H 2
Кислород, O 2
Хлор, Cl 2
Азот, N 2
Перечислите все вещества из таблицы, которые являются соединениями. Напишите их имена и формулы.Вода, H 2 O
Двуокись углерода, CO 2
Диоксид серы, SO 2
Натрия хлорид, NaCl
Сероводород, H 2 S
Аммиак, NH 3
Как вы узнали, какие вещества в таблице являются соединениями, а не элементами?
Вы, наверное, искали, чтобы увидеть, какие из них состоят из более чем одного вида атомов.Соединение — это материал, состоящий из атомов двух или более различных элементов. Элементы не просто физически смешаны, но химически связаны друг с другом на атомном уровне.
Вода (H 2 O), диоксид углерода (CO 2 ) и соль или хлорид натрия (NaCl) являются примерами соединений, тогда как газообразный кислород (O 2 ), газообразный водород (H 2 ) и газообразный азот (N 2 ) являются примерами элементов.
Соединение формулы H 2 O 2 также состоит из атомов водорода и кислорода.Формула говорит нам, что одна молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода. H 2 O 2 то же самое, что вода? Что вы думаете?
Не путайте H 2 O 2 с H 2 O! H 2 O 2 представляет собой соединение, называемое пероксидом водорода. Перекись водорода похожа на воду в том, что при комнатной температуре (25 ° C) это прозрачная бесцветная жидкость, хотя и не такая жидкая, но во многих отношениях она отличается.Следующие свойства перекиси водорода могут убедить вас в том, что она не такая, как вода:
- Пероксид водорода имеет температуру кипения 150 ° C и является очень эффективным отбеливателем для одежды и волос.
- Концентрированная перекись водорода настолько реактивна, что используется в качестве компонента ракетного топлива!
- Перекись водорода чрезвычайно агрессивна.
- Мы можем пить воду, но перекись водорода очень опасна и вредна.
Коррозионные вещества — это вещества, которые вызывают повреждение металла или других материалов в результате химического процесса.Представьте, что дождевая вода вызывает ржавчину, разъедающую металл.
Если это вас не убеждает, давайте сравним, как выглядит молекула перекиси водорода рядом с водой:
Перекись водорода. Вода.Несмотря на то, что они состоят из одних и тех же элементов, эти два соединения очень разные, и их никогда не следует путать друг с другом.
Целью приведенного выше сравнения перекиси водорода и воды было показать вам, что атомы в данном соединении всегда соединяются в фиксированном соотношении.Во всех молекулах воды во Вселенной всегда будут связаны один атом O и два атома H.
Это был пятый постулат Далтона:
5. Атомы химически соединяются в фиксированных соотношениях с образованием соединений.
Как атомы «сочетаются»? Что заставляет их слипаться и образовывать молекулы?
Химические связи
Посмотрите на фото с различными вариантами расположения металлических шариков. Эти шарики магнитные, что позволяет создавать различные узоры, склеивая их вместе.Что заставляет магниты склеиваться?
Учащиеся могут сказать, что магниты слипаются, потому что они притягивают друг друга. Укажите им, что магниты действительно будут притягиваться друг к другу, если они выстроены правильно. Магниты также могут отталкивать друг друга, если они расположены по-другому. Учащиеся будут больше изучать магнитные силы в Gr. 9 Энергия и перемены.
Эти шары магнитные. http://www.flickr.com/photos/uscpsc/6331652875/Магниты притягивают (или отталкивают) друг друга из-за магнитной силы между ними (вы узнаете больше о магнитах в Gr.9). Когда атомы объединяются, они делают это, потому что они также испытывают силу притяжения. Сила немного сложнее, чем сила между магнитами, но работает она так же: сила удерживает атомы вместе, как будто они склеены клеем. Силы, удерживающие атомы вместе, называются химическими связями .
В молекуле воды химические связи между О и двумя атомами Н удерживают всю молекулу вместе. Сколько химических связей в каждой молекуле воды? Если вы не уверены, посмотрите на диаграмму ниже:
Две облигации.Если на этом этапе вы хотите вывести учащихся за рамки требований учебной программы, вы могли бы дать краткое объяснение электронного обмена. Детали этого будут изучены только в Gr. 10. Эти прочные химические связи, называемые ковалентными связями, образуются, когда атомы делятся своими электронами. Это объясняет, почему после реакции разложения атомы немедленно преобразуются во что-то другое: требование совместного использования электронов, которое привело к первоначальной связи, все еще существует, они просто разделяют электроны с другим атомом.
Молекула воды имеет две идентичные связи O-H. Что бы произошло, если бы у нас было достаточно энергии, чтобы разорвать эти узы?
Если бы у нас было достаточно энергии, чтобы разорвать связи O-H, мы смогли бы отделить атомы друг от друга.
Что бы мы получили, если бы разделили молекулы воды на атомы? Теоретически у нас были бы атомы водорода и кислорода. На самом деле происходит то, что атомы водорода немедленно объединяются с образованием H 2 , а атомы кислорода немедленно объединяются с образованием O 2 .
Когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция .
В указанной выше химической реакции вода разложилась (распалась) и рекомбинировала на более мелкие молекулы. Мы говорим, что вода подверглась реакции разложения в приведенном выше примере. Конечно, не все химические реакции являются реакциями разложения. Есть много различных видов химических реакций, и мы собираемся исследовать некоторые примеры в следующем разделе.
Химические реакции
Во всех химических реакциях происходят два важных события:
- разрыв химических связей
- новые химические связи образуют
Это означает, что в всех химических реакциях атомы в молекулах перестраиваются, образуя новые молекулы.
В следующем упражнении мы собираемся смоделировать реакцию разложения воды с помощью глины или шариков из пластилина для представления различных атомов.
Это дополнительное расширение.Позднее в семестре учащиеся будут больше изучать химические реакции.
МАТЕРИАЛЫ:
- пластилин или пластилин двух разных цветов
ИНСТРУКЦИЯ:
- Соберите две молекулы воды из глины или пластилина. Посмотрите на предыдущие изображения, чтобы напомнить вам, как выглядит молекула воды. Вы можете использовать глину любого цвета для создания своей.
- Теперь разорвите все связи, удерживающие молекулы вместе, разделив их на отдельные атомы.
Ответьте на следующие вопросы:
Сколько у вас атомов водорода (H)?
Сколько у вас атомов кислорода (O)?
Объедините атомы водорода и кислорода в молекулы водорода (H 2 ) и молекулы кислорода (O 2 ).
Ответьте на следующие вопросы:
Сколько молекул водорода можно построить из атомов H?Две молекулы водорода (H 2 ) могут состоять из четырех атомов H.
Сколько молекул кислорода можно построить из атомов O?Одна молекула кислорода (O 2 ) может состоять из двух атомов O.
Можете ли вы написать химическое уравнение для реакции, которую вы только что построили, с помощью глиняных моделей? Посмотрите на схему для вдохновения:
2 H 2 O \ (\ rightarrow \) 2 H 2 + O 2
Химические уравнения будут должным образом представлены в последней главе Gr.8 Материя и материалы, но это может быть хорошим местом для начала ознакомления учащихся с этим. Вы могли бы объяснить, что когда есть только одна молекула определенного типа (O 2 в приведенном выше примере), мы не пишем число перед ней в химической реакции. На данном этапе балансировка уравнений не требуется.
Давайте посмотрим на другой пример химической реакции: реакция, когда углерод (в угле) реагирует с кислородом (в воздухе) с образованием диоксида углерода:
Вы можете использовать шарики из пластилина для имитации этой реакции.
Попробуйте написать химическое уравнение реакции, когда углерод и кислород соединяются с образованием диоксида углерода. (Подсказка: используйте схему, чтобы направлять вас.)
C + O 2 \ (\ rightarrow \) CO 2
Как атомы угля и кислорода перегруппировываются с образованием диоксида углерода? Какие облигации рвутся?
Связь между двумя атомами кислорода разрывается.
Какие новые облигации образуют?
Две новые углерод-кислородные связи образуются при образовании диоксида углерода.
Затем ваш учитель продемонстрирует классу две химические реакции. Ваша задача — внимательно наблюдать и записывать свои наблюдения, которые вы можете видеть в происходящем.
Мы предлагаем сделать это в качестве демонстрации или поставить несколько экспериментов в классе, за которыми могут наблюдать разные группы учащихся. Видео в окне для посещения содержит простую демонстрацию электролиза с использованием сульфата меди вместо хлорида меди. Но наблюдения будут такими же, а именно, что медь покрывает катод, и вы можете наблюдать пузырьки газа на аноде (на видео это газообразный кислород, а не газообразный хлор, как в исследовании здесь, в рабочей тетради.
Видео, демонстрирующее аналогичную реакцию с использованием сульфата меди.
AIM: Определить, можно ли разложить хлорид меди с помощью электроэнергии.
МАТЕРИАЛЫ И АППАРАТ:
- стакан
- картонный диск, достаточно большой, чтобы закрыть верхнюю часть стакана
- два графитовых электрода
- 2 бита провода
- Растворы хлорида меди
- аккумулятор 9 вольт
Вместо графитовых электродов вы также можете получить угольные электроды из использованных ячеек горелки.
Длина провода с зажимами типа «крокодил» на обоих концах является идеальной. Они понадобятся вам для построения электрической цепи. Включение переключателя в схему не является обязательным.
Раствор хлорида меди можно приготовить, растворив две чайные ложки хлорида меди (II) в стакане водопроводной воды.
Перед запуском сделайте следующие наблюдения:
Какого цвета раствор хлорида меди?Какого цвета графитовые электроды?
МЕТОД:
- Налейте раствор хлорида меди в стакан.
- Сделайте два небольших отверстия в картонном диске и протолкните электроды через отверстия, как показано на следующем рисунке.
- Поместите диск над стаканом так, чтобы большая часть каждого электрода находилась под поверхностью раствора.
- Подсоедините верхние части электродов к концам батареи с помощью длин проводов. Взгляните на схему экспериментальной установки.
- Дайте реакции развиться в течение нескольких минут и посмотрите, что произойдет.
- Когда реакция длится примерно 10 минут, можно отсоединить провода и разобрать установку.
НАБЛЮДЕНИЯ:
Что вы наблюдаете на поверхности двух электродов после того, как реакция длилась несколько минут?Один электрод покрывается маленькими пузырьками, а другой становится коричневым.
Какого цвета в конце эксперимента был хлорид меди?Решение все еще синее.
Если вы сохранили часть исходного решения, учащиеся могут сравнить решение до и после эксперимента. Они могут заметить, что решение «после» не такое синее, как решение «до». Попросите учащихся задуматься, почему это могло быть. Это связано с двумя причинами:
- ионы меди выходят из раствора, поскольку они принимают электроны и превращаются в твердую медь, которая выделяется на катоде красновато-коричневого цвета. (Учащиеся еще не знают об обмене ионами или электронами, поэтому они могут предположить, что атомы / частицы меди выходят из раствора и накапливаются на электроде.)
ионов хлора образуют газообразный хлор Cl 2 на аноде. (Учащиеся могут наблюдать образование пузырьков газа на другом электроде и, возможно, сделать вывод, что это хлорид, выходящий из раствора в виде газообразного хлора.)
Следовательно, , концентрация раствора хлорида меди становится слабее, в результате чего он становится немного менее синим.
Как изменился внешний вид графитовых электродов?Один электрод остается темно-серым или черным.Другой электрод покрыт красновато-коричневым слоем.
Можно отметить, что электрод, который остался серо-черным, был тем же электродом, на котором раньше были пузырьки. Пусть некоторые из учащихся почувствуют запах этого электрода. Они могут чувствовать запах отбеливателя, который представляет собой запах газообразного хлора Cl 2 . Попросите учащихся сравнить цвет слоя с цветом медной монеты. Может ли налет на втором электроде быть медью? Да, это так.
Учащимся не нужно понимать, что происходит в растворе на ионном уровне.Акцент здесь делается на демонстрации того, что соединение можно разбить на элементы. Тем не менее, объяснение электролиза раствора хлорида меди (II) приводится здесь для справки, и если вы хотите расширить свои знания учащихся:
Когда электроды подключены к источнику питания, электроны перемещаются, заставляя электрод, прикрепленный к положительному концу батареи, становиться положительным. Он называется анодом . Отрицательно заряженные ионы хлорида в растворе притягиваются к положительному аноду.Ионы хлора отдают свои электроны и образуют газообразный хлор, который наблюдается в виде пузырьков.
Электрод, прикрепленный к отрицательному полюсу батареи, становится отрицательным. Он называется катодом . На катоде положительно заряженные ионы меди в растворе притягиваются к отрицательному электроду. На катоде ионы меди получают электроны, образуя металлическую медь, которая осаждается на катоде. Наблюдается коричневый налет.
(Вы можете попросить учащихся нарисовать положительные и отрицательные знаки и пометить электроды на схемах в своих рабочих тетрадях в качестве дополнения.)
Электрод, прикрепленный к положительной стороне батареи, является положительным электродом и называется анодом . Электрод, прикрепленный к отрицательной стороне батареи, является отрицательным электродом и называется катодом .
Обобщите ваши экспериментальные наблюдения в следующей таблице.
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | |
До эксперимента | 603|||
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | |
Перед экспериментом | интенсивно-синий цвет. | Темно-серая поверхность. | Темно-серая поверхность. |
После эксперимента | Раствор все еще был синим, но цвет был менее интенсивным. | Поверхность темно-серая, но со слабым запахом отбеливателя. Во время реакции пузырьков не наблюдалось. | Красновато-коричневый налет на поверхности. |
АНАЛИЗ И ОБСУЖДЕНИЕ:
Что придало раствору хлорида меди насыщенный синий цвет?Хлорид меди, растворенный в нем.
Как вы думаете, часть хлорида меди могла измениться во время реакции во что-то другое? Объясните, почему вы так думаете.Раствор хлорида меди стал менее голубым. Это говорит нам о том, что часть хлорида меди превратилась во что-то другое.
Как бы вы объяснили пузырьки на поверхности первого электрода? Вы хоть представляете, какими они могли быть? Подсказка: чем потом пахнет электрод?Пузырьки означают, что на поверхности электрода образовался газ.Пахло отбеливателем. Газообразный хлор также пахнет отбеливателем, поэтому возможно, что газ, образующийся на электроде, мог быть хлором.
Примечание: Хлор фактически является активным ингредиентом отбеливателя.
Вы знаете, что такое красновато-коричневый налет на втором электроде? Подсказка: какой металл имеет такой же характерный красновато-коричневый цвет?Возможно, красновато-коричневый налет — это медь.
Как мы узнаем, что произошла химическая реакция?Атомы в хлориде меди были перегруппированы, чтобы образовать различные материалы: медь (Cu) и хлор (Cl 2 ).
ВЫВОД:
Напишите заключение для расследования. В своем заключении вам следует переписать цель расследования в заявление о результатах вашего расследования.Заключение обучаемого должно содержать как минимум два из следующего:
Как вы думаете, возможно ли разделить хлорид меди на медь и хлор с помощью любого из методов физического разделения, о которых мы узнали в Gr.7 Материя и материалы, такие как просеивание, фильтрация, выпаривание, дистилляция или хроматография? Вот подсказка: ни один из этих методов не может разорвать связи между атомами в веществе.
Ответ — нет. Медь и хлор химически связаны в хлориде меди. Мы знаем это из его химической формулы: CuCl 2 . Методы физического разделения могут использоваться только для разделения смесей на вещества, из которых они состоят.
На данный момент мы узнали об атомах, молекулах, элементах и соединениях.Иногда эти концепции сбивают с толку, потому что они описывают вещи, которые слишком малы, чтобы их можно было увидеть, а иногда и трудно представить. В следующем разделе мы вернемся к идее смесей и посмотрим, как все, что мы узнали до сих пор, можно поместить в схему классификации материи и материалов.
Учебная программа восьмого класса — Обучение на дому
Учебная программа восьмого класса знакомит учащихся с концепциями гражданского общества посредством изучения борцов за свободу, федерального правительства, правительства штата и местного самоуправления, а также экономической системы.
Пакет для 8 класса с саксонской алгеброй 1/2 Учебный план восьмого классаOak Meadow предлагает комплексную и сложную программу обучения, которая вовлекает учащихся в активное обучение.
Было: 795 долларов.00
Сейчас: $ 636,00
Скидки
Пакет для 8-го класса с саксонской алгеброй 1 Учебный план восьмого класса Oak Meadow предлагает комплексную и сложную программу обучения, которая вовлекает учащихся в активное обучение.
Было: 795 долларов.00
Сейчас: $ 636,00
Скидки
Учебник английского языка для 8 классаСтуденты читают классические романы, рассказы и стихи, изучая словарный запас, грамматику и навыки сочинения.
Было: 125 долларов.00
Сейчас: $ 100,00
Скидки
Учебник по физическим наукам для 8 классаЛабораторное руководство, необходимое для использования с этой книгой
Студенты проводят наблюдения и лабораторные исследования химических реакций, сил и взаимодействий, энергии, волн, электричества, магнетизма и инженерного дизайна.
Был: 125,00 $
Сейчас: 100,00 $
Скидки
Руководство лаборатории физических наук для 8 классаТребуется для прохождения курса физических наук в 8-м классе Oak Meadow (лабораторный комплект продается отдельно), но также может использоваться независимо в качестве дополнения к другим учебным программам по физическим наукам.
Лабораторные исследования химических реакций, сил и взаимодействий, энергии, волн, электричества, магнетизма и инженерного проектирования.
Был: 25,00 $
Сейчас: 20,00 $
Скидки
Комплект для научной лаборатории 8-го классаНЕ ВХОДИТ В ПАКЕТЫ 8-ГО КЛАССА
Индивидуальный лабораторный комплект для лабораторных исследований: физика
Было: 125 долларов.00
Сейчас: $ 100,00
Скидки
Учебник по основам обществоведения для 8 классаСтуденты развивают понимание социальных и политических вопросов посредством исследований, размышлений, дискуссий и практических занятий.
Было: 125 долларов.00
Сейчас: $ 100,00
Скидки
Дубовый луг пустой журналOak Meadow Blank Journals (50 страниц) идеально подходят для заметок, набросков, наблюдений или для записи мыслей, идей, вопросов и снов.
Было: 9 долларов.00
Сейчас: 7,20 $
Скидки
Руководство по решениям Saxon Algebra 1/2Руководство по решениям, рекомендованное для использования с домашним школьным комплектом Saxon Algebra 1/2. Не входит в пакет для 8-го класса.
Был: 75,00 $
Сейчас: 57,60 $
Скидки
Набор для домашнего обучения по саксонской алгебре I, 3-е изданиеВводный курс алгебры, охватывающий выражения, показатели и корни, абсолютные значения, теорему Пифагора, доказательства, функции и квадратные уравнения.
Рекомендуемый уровень обучения: 8, 9, 10
Был: 125,00 $
Сейчас: 100,00 $
Скидки
Руководство по решениям Saxon Algebra IРуководство по решениям, рекомендованное для использования с набором для домашнего обучения Saxon Algebra 1.Не входит в пакет для 8-го класса.
Был: $ 75,00
Сейчас: $ 60,00
Скидки
Морщинка во времениНазначен как часть учебной программы по английскому языку для восьмых классов Oak Meadow.
Был: 6,99 $
Сейчас: 5,59 $
Скидки
Бейсбол в апрелеНазначен как часть учебной программы по английскому языку для восьмых классов Oak Meadow.
Было: 7 долларов.99
Сейчас: $ 6,39
Скидки
Крест-накрестНазначен как часть учебной программы по английскому языку для восьмых классов Oak Meadow.
Было: 19,95 $
Сейчас: 15,96 $
Скидки
ЭхоНазначен как часть учебной программы по английскому языку для восьмых классов Oak Meadow.
Был: 17,95 $
Сейчас: 14,36 $
Скидки
Оставь эту песню позадиНазначен как часть учебной программы по английскому языку для восьмых классов Oak Meadow.
Было: 12 долларов.95
Сейчас: $ 10,36
Скидки
Луна над манифестомНазначен как часть учебной программы по английскому языку для восьмых классов Oak Meadow.
Был: 7,99 $
Сейчас: 6,39 $
Скидки
ДающийНазначен как часть учебной программы по английскому языку для восьмых классов Oak Meadow.
Было: 9,99 $
Сейчас: 7,99 $
Скидки
Наука в средней школе | Государственные школы округа Фэйрфакс
Курсов:
7 класс (ГОСТ)
8 класс (ГОСТ)
Focus Science
Требования лаборатории
Центральное место в разработке учебной программы занимает философия, согласно которой учащийся средней школы, занимающийся естественными науками, должен заниматься лабораторной работой в течение как минимум пятидесяти процентов учебного времени.Эти временные рамки включают предлабораторную подготовку и постлабораторный анализ. Лабораторная работа — это средство, с помощью которого студенты приходят к пониманию концепций наук о жизни, изучают и применяют навыки исследования и приобретают энтузиазм в изучении науки. Несмотря на важность для развития понимания учащимися, демонстрации, аудиовизуальные презентации, подкрепление и практические занятия, а также дополнительное чтение не могут считаться заменой лабораторного опыта. Эти виды деятельности не должны учитываться в рамках лабораторного времени.
Опыт научной лаборатории характеризуется следующим:
- Отдельный студент или небольшая группа студентов, манипулирующих научным оборудованием с целью проведения расследования, требующего интерпретации наблюдений и данных.
- Отдельное лицо или небольшая группа студентов, занимающихся экспериментальным дизайном, который включает определение проблемы, формулирование гипотез и установление процедур для сбора проверяемых данных.
- Отдельное лицо или небольшая группа студентов, проводящих расследование, которое включает в себя проведение наблюдений, запись данных наблюдений, анализ собранных данных, формулирование выводов и подготовку окончательного отчета.
Отдельное лицо или небольшая группа студентов, занимающихся компьютерными лабораторными исследованиями. Чтобы компьютерное лабораторное исследование можно было рассматривать как лабораторную деятельность, программа должна включать в себя следующее:
- Развитие научных навыков, таких как проведение наблюдений, сбор данных, организация и анализ данных, прогнозирование и выводы.
- Возможность изменять параметры результатов для наблюдения и прогнозирования воздействия на исследуемую систему.
- Экспериментальные исследования, которые генерируют или получают доступ к соответствующим данным, отображают данные и требуют от студентов их анализа для формирования обоснованных выводов.
Полевые исследования, в которых отдельные студенты участвуют в наблюдениях, сборе данных и анализе образцов материалов.
Технологии
Как указано в Стандартах естественных наук для государственных школ штата Вирджиния, использование современных и новых технологий имеет важное значение для учебной программы K-12.
Компьютерные / технологические стандарты, которые должны быть достигнуты к концу 8-го класса, были разработаны в Стандартах обучения штата Вирджиния и являются общей обязанностью учителей всех дисциплин. Ожидается, что учащиеся средних научных школ научатся использовать составной микроскоп, трехлучевые весы, компьютер, принтер, цифровую камеру, пробное ПО, LabQuest и другие виды оборудования.
Кроме того, студенты должны стать компетентными в использовании программного обеспечения, разработанного для следующих приложений: обработка текста, построение графиков, управление базами данных, моделирование, географические информационные системы (ГИС), телекоммуникации и мультимедийные презентации.Наиболее распространенная конфигурация — это сетевой научный класс, состоящий из 15 станций для студентов и одной станции для презентаций учителей. Все учащиеся средней школы, изучающие естественные науки, используют технологии во время каждого раздела в течение года.
Методы оценивания в классе
Обучение может быть эффективным только в том случае, если оценки в классе точно отражают достижения учащихся. По этой причине те, кто заботится о качестве обучения, также должны заботиться о качестве оценки.Оценка должна быть систематическим, многоэтапным процессом, включающим сбор и интерпретацию образовательных данных об успеваемости учащихся. Успеваемость учеников определяет, чему должны учить учителя, отражает то, что ученики узнали, и указывает, что ученикам необходимо изучить.
В прошлом многие преподаватели оценивали понимание студентами научной концепции с помощью традиционного теста с несколькими вариантами ответов, карандашом и бумагой. Сегодня учителя используют различные методы оценки в классе, чтобы проверить степень и организацию знаний своих учеников.Выбор конкретных методов оценки должен соответствовать типу оцениваемых нами знаний — концептуальных или процедурных. Концептуальные знания относятся к тому, что мы хотим, чтобы студенты понимали (концепции, принципы), а процедурные знания относятся к тому, что мы хотим, чтобы студенты могли делать (навыки, процессы, стратегии).
К методам оценки естественных наук в классе относятся следующие:
1. Выбранный ответ
Студент выбирает правильный или лучший ответ из предложенных вариантов.Этот метод позволяет оценить владение концептуальными или процедурными знаниями.
Примеры выбранного ответа включают множественный выбор, истина-ложь и соответствие.
2. Сконструированный ответ
Студент дает краткий ответ, обычно в письменной форме, на вопросы, проблемы или подсказки. Этот метод позволяет оценить большие концепции, обобщения и отношения между элементами концептуального знания. Это может дать представление о способности студента к рассуждению. Контрольный список производительности или критерии могут быть использованы для «оценки» ответа.
Примеры сконструированного ответа включают просьбу учащихся построить график экспериментальных данных и описать очевидную закономерность или тенденцию, создать концептуальную карту или паутину по научной теме или составить помеченную диаграмму, чтобы проиллюстрировать и объяснить роль зеленых растений в процесс фотосинтеза, прося студентов «показать и объяснить свою работу» по проблеме расчета плотности или составить помеченную диаграмму, чтобы проиллюстрировать и объяснить три способа передачи тепловой энергии.
3. Оценка результатов деятельности
A. Задача производительности
Студент создает продукт или проводит демонстрацию, демонстрирующую, как он или она может применить концептуальные знания и процедурные навыки для выполнения шагов в разработке указанного продукта или задачи. Он может оценить как концептуальные, так и процедурные знания. Оценка студенческих продуктов основана на суждениях, основанных на критериях. Рубрики и контрольные списки результатов часто используются в качестве инструментов оценки.
Примеры служебного задания включают в себя задание учащихся написать редакционную статью в газете, защищающую позицию о сокращении промысла синего краба Чесапикского залива; спланировать эксперимент по определению факторов, ограничивающих прорастание конкретного вида семян; создать учебник по использованию микроскопа для сравнения растительной и животной клетки для ученика пятого класса; создать мультимедийную презентацию ко Дню Земли о взаимозависимости с биосферой, написать редакционную статью в газете, защищающую позицию по использованию ядерной энергии для производства электроэнергии; разработать эксперимент по определению влияния различных видов изоляционных материалов на потери тепловой энергии; создать учебник по «атомам и элементам» для шестиклассников; провести эксперимент по выявлению неизвестного вещества по его свойствам; создать мультимедийную презентацию для Национальной недели науки и технологий о взаимозависимости науки, технологий и общества в некоторых аспектах программы нанотехнологий.
B. Портфель
Репрезентативные образцы студенческих работ целенаправленно собираются с течением времени. Это может быть использовано для демонстрации усилий, прогресса или достижений учащихся в данной области.
Пример портфолио включает просьбу к студентам вести учет различных исследований или лабораторных отчетов с течением времени, чтобы увидеть прогресс в способности проводить качественные и количественные наблюдения, систематизировать и анализировать информацию и сообщать результаты расследования.
C. Наблюдения учителя, вопросы и конференц-связь
Учитель наблюдает за учеником во время занятия или задает вопросы, чтобы узнать о мыслительном процессе ученика, имеющем отношение к концептуальным или процедурным знаниям. Они предоставляют ценную обратную связь для учителей и учеников, чтобы можно было внести коррективы в обучение.
Примеры наблюдений учителей, опроса и конференц-связи включают наблюдение за студентами в лабораторных условиях для определения их способности следовать письменной процедуре, использование техники «мысли вслух» для оценки способности ученика делать мокрое крепление сдвинуть и сфокусировать изображение под микроскопом или использовать весы с тройным лучом, чтобы определить массу объекта, задавая устные вопросы, чтобы оценить понимание учащимся сложного раздела учебника естественных наук, или провести конференцию со студентом, чтобы узнать, что он знает о конкретной концепции и о том, какие вопросы у них еще могут быть.
D. Самооценка учащихся
Учащийся самостоятельно оценивает качество выступления, продукта или процесса, которые он использовал. Этот метод позволяет ученикам отслеживать свой прогресс по критериям, установленным учеником и учителем. Это также позволяет студентам участвовать в процессе обучения и брать на себя ответственность за понимание целей и критериев успеха, связанных с концептуальными и процедурными целями обучения.
Примеры самооценки учащихся включают разрешение учащимся использовать контрольный список для оценки качества созданного ими графика: или после завершения серии уроков по наследственности просьбу учащихся записать в учебный журнал найденные ими концепции самые понятные и те, в которых они до сих пор не до конца понимают.
.

 Не разрешается разбирать прибор и заполнять его специально каким-либо газом.
Не разрешается разбирать прибор и заполнять его специально каким-либо газом. Методы очистки веществ
Методы очистки веществ
 Степень окисления. Составление формул по валентностям и степеням окисления
Степень окисления. Составление формул по валентностям и степеням окисления
 Растворимость
Растворимость
 Индикаторы
Индикаторы
 Катализаторы
Катализаторы
 Хлор и его соединения
Хлор и его соединения
 Полимеры
Полимеры
 Химия и здоровье
Химия и здоровье
 Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества