Химия Усманова М. 8 класс 2018 Упражнение 1 ГДЗ(дүж) решебник KZGDZ.COM
§45. Химические свойства кислот A Упражнение 1
← Предыдущий Следующий →
§1. Распределение электронов в атомах
A
Упражнение
123
B
Упражнение
12
C
Упражнение
12
§2. Электронные формулы атомов
A
Упражнение
12
B
Упражнение
123
C
Упражнение
123
§3. Образование ионов
A
Упражнение
123
B
Упражнение
123
C
Упражнение
123
§4. Составление формул соединений
A
Упражнение
123
B
Упражнение
123
C
Упражнение
123
§5.
 Расчеты по химическим формулам
Расчеты по химическим формуламA
Упражнение
1234
B
Упражнение
1234
C
Упражнение
12
§6. Составление уравнений химических реакций
A
Упражнение
12
B
Упражнение
12
C
Упражнение
123
§7. Закон сохранения массы веществ
A
Упражнение
12
B
Упражнение
12
C
Упражнение
12
§8. Соотношение масс реагирующих веществ. Закон постоянства состава
A
Упражнение
12
B
Упражнение
123
C
Упражнение
12
§9.
 Типы химических реакций
Типы химических реакцийA
Упражнение
12
B
Упражнение
12
C
Упражнение
123
§10. Химические реакции в природе и жизнедеятельности живых организмов и человека
A
Упражнение
12
B
Упражнение
12
C
Упражнение
12
§11. Реакции металлов с кислородом и водой
A
Упражнение
123
4
B
Упражнение
1234
C
Упражнение
123
§12. Взаимодействие металлов с кислотами. Ряд активности металлов
A
Упражнение
1234
B
Упражнение
12
C
Упражнение
12
§13.
 Взаимодействие металлов с растворами солей
Взаимодействие металлов с растворами солейA
Упражнение
1234
§14. Количество вещества. Число Авогадро. Молярная масса вещества
Упражнение
12
B
Упражнение
12
C
Упражнение
1
§15. Взаимосв язь массы , мол ярно й массы и коли чества вещества
A
Упражнение
12
B
Упражнение
12
C
Упражнение
12
§16. Решение задач по уравнениям химических реакций
A
Упражнение
12
B
Упражнение
1
C
Упражнение
12
§17. Закон Авогадро. Молярный объем газов
A
Упражнение
123
B
Упражнение
1234
C
Упражнение
12345
§18.
 Относительная плотность газов
Относительная плотность газовA
Упражнение
123
B
Упражнение
12
C
Упражнение
1234
§19. Закон объемных отношений
A
Упражнение
123
B
Упражнение
12
C
Упражнение
12
§20. Горение топлива и выделение энергии
A
Упражнение
12
B
Упражнение
12
C
Упражнение
1
§21. Экзотерми ческие и эндотерми ческие реакции. Термохимические уравнения
A
Упражнение
12
B
Упражнение
12
C
Упражнение
12
§22.
 Расчеты по термо химическим уравнениям
Расчеты по термо химическим уравнениямA
Упражнение
12
B
Упражнение
123
C
Упражнение
123
§23. Водород . Получение , физические свойства и применение
A
Упражнение
12345
B
Упражнение
1234
C
Упражнение
123
§24. Химические свойства водорода
A
Упражнение
123
B
Упражнение
123
C
Упражнение
123
§25. Кислород. Распространение кислорода в природе. Получение
A
Упражнение
1234
B
Упражнение
12345
C
Упражнение
12345
§26.
 Химические свойства кислорода
Химические свойства кислородаA
Упражнение
1234
B
Упражнение
1234
C
Упражнение
1234
§27. Озон
A
Упражнение
123
B
Упражнение
123
C
Упражнение
12
§28. Структура периодической системы химических элементов
A
Упражнение
12
B
Упражнение
123
C
Упражнение
123
§29. Периоди ческое изменение некоторы х характеристик и свойств атомов химических элементов
A
Упражнение
123
B
Упражнение
123
C
Упражнение
1234
§30.
 Характеристика элемента по положению в Периодической системе
Характеристика элемента по положению в Периодической системеA
Упражнение
123
B
Упражнение
1
23
C
Упражнение
123
§31. Естественные семейства химических элементов и их свойства. Щелочные металлы
A
Упражнение
1
B
Упражнение
123
C
Упражнение
123
§32. Галогены и инертные газы
A
Упражнение
1
B
Упражнение
12
C
Упражнение
123
§33. Металлы и неметаллы
A
Упражнение
12
B
Упражнение
123
C
Упражнение
123
§34.
 Электроотри цательность
Электроотри цательностьA
Упражнение
123
B
Упражнение
123
C
Упражнение
123
§35. Ковалентна я связь
A
Упражнение
12
B
Упражнение
12
C
Упражнение
12
§36. Ионная связь
A
Упражнение
12
B
Упражнение
123
C
Упражнение
1234
§37 Взаимосвязь между типами связей, видами кристаллических решеток и свойствами веществ
A
Упражнение
12
B
Упражнение
123
C
Упражнение
123
§38.
 Растворение веществ в воде. Растворимость
Растворение веществ в воде. РастворимостьA
Упражнение
123
B
Упражнение
12
C
Упражнение
12
§39. Решение задач, связанных с растворимостью веществ
A
Упражнение
12
B
Упражнение
12
C
Упражнение
12
§40. Массова я доля растворенно го вещества
A
Упражнение
123
B
Упражнение
12
C
Упражнение
12
§41. Молярная концентрация вещества в растворе
A
Упражнение
12
B
Упражнение
12
C
Упражнение
12
§42.
 Оксиды
ОксидыA
Упражнение
1234
B
Упражнение
12345
C
Упражнение
1234
§43. Химические свойства оксидов
A
Упражнение
12345
B
Упражнение
12345
C
Упражнение
123
§44. Кислоты
A
Упражнение
1234
B
Упражнение
1234
C
Упражнение
1234
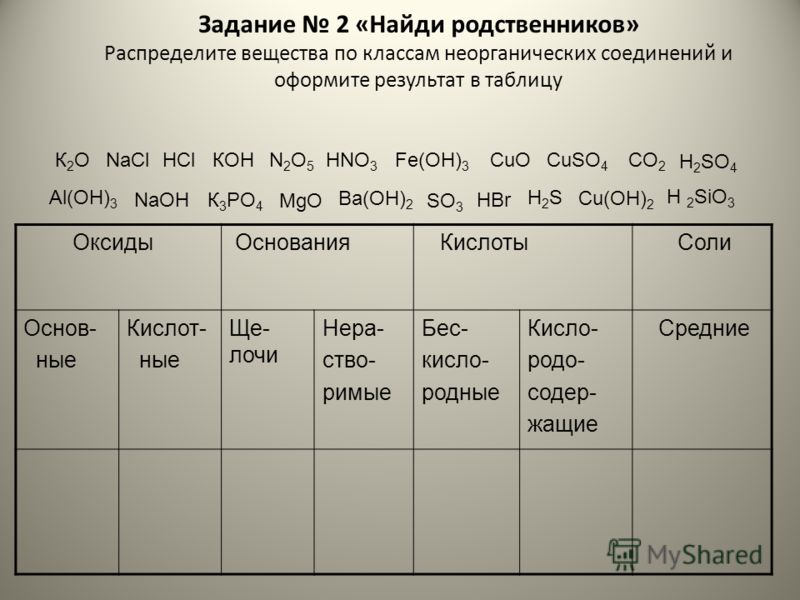
§45. Химические свойства кислот
A
Упражнение
12345
B
Упражнение
1234
C
Упражнение
1234
§46. Основания. Состав, номенклатура
A
Упражнение
12
B
Упражнение
1
C
Упражнение
1
§47.
 Химические свойства оснований
Химические свойства основанийA
Упражнение
123
B
Упражнение
123
C
Упражнение
12
§48. Соли: классификация, номенклатура
A
Упражнение
1234
B
Упражнение
12345
C
Упражнение
1234
§49. Химические свойства солей
A
Упражнение
1234
B
Упражнение
123
C
Упражнение
1234
§50. Генети ческа я связь ме жду классами неорганических соединений
A
Упражнение
1234
B
Упражнение
1234
C
Упражнение
123
§51.
 Общая характеристика углерода
Общая характеристика углеродаA
Упражнение
123
B
Упражнение
12
C
Упражнение
1
§52. Химические свойства углерода
A
Упражнение
1
B
Упражнение
12
C
Упражнение
12
§53. Оксиды углерода
A
Упражнение
12
B
Упражнение
123
C
Упражнение
123
§54. Вода в природе
A
Упражнение
123
B
Упражнение
123
§55. Хими ческие свойства воды
A
Упражнение
123
B
Упражнение
123
C
Упражнение
123
§56.
 Причины за грязнени я воды . Жесткость воды и способы ее устранения
Причины за грязнени я воды . Жесткость воды и способы ее устраненияA
Упражнение
12
B
Упражнение
12
C
Упражнение
12
Химические уравнения — как расставлять коэффициенты?
Химическое уравнение — это условная запись химического превращения с помощью химических формул и математических знаков
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.
Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в ходе этой реакции.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Алгоритм составления уравнения химической реакции
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны. Между исходными веществами ставим «+», а затем знак «=».
После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.

Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Это важно
Коэффициент 1 в уравнении химической реакции не указывается, но при подсчете суммы коэффициентов в уравнении его необходимо учитывать.
Проверим количество атомов магния до и после знака «=». Если перед химической формулой уже стоит коэффициент, то для подсчета количества атомов необходимо умножить коэффициент на индекс, который относится к этому химическому элементу.
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=».
 Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
По числу и составу исходных веществ и продуктов реакции.

По изменению степени окисления.
По тепловому эффекту.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По обратимости.
По числу и составу исходных веществ и продуктов реакции
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
2Ba + O2 = 2BaO.
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Na2O + H2O = 2NaOH.
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
2AgNO3 = 2Ag + 2NO2↑ + O2↑.
Что это за стрелочка? 🤔
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Также возможно замещение функциональных групп в сложном веществе.
Zn + 2HCl = ZnCl2 + H2↑.
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Например, NaOH + H2SO4 = Na2SO4 + H2O.
Реакции нейтрализации
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;

В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов ( восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
CaCO3 = CaO + CO2 − Q.
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
2H2 + O2 = 2H2O + Q.
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
H2(г) + Cl2(г) = 2HCl.
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
2Na(тв) + 2H2O(ж) = 2NaOH + H2.
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Q13 Сбалансируйте следующие уравнения a b c d e f g h i j k l m n o p q r s t u …
Решение:
(a) P+O_2\ →\ P_2O_5
Число атомов P и O должно быть одинаковым с обеих сторон
Имеется 2 атома кислорода
P+5O_2\ →\ 2P_2O_5
Теперь 4 атома P справа и 1 справа
Теперь уравнение
4P+O_2\ →\ 2P_2O_5
(b) Na_2O\ +\ H_2O\ →\ NaOH
Число атомов Na, H и O должно быть одинаковым с обеих сторон
2 атома Na на левой стороне и 1 на правой стороне , H и O должны быть равны с обеих сторон
На левой стороне 2 атома H, а на правой 3
K\ +\ 2H_2O\ →\ 2KOH\ +\ H_2
Теперь 1 атом K на слева и 2 справа
2K\ +\ 2H_2O\ →\ 2KOH\ +\ H_2
(d) Fe\ +\ H_2O\ →\ Fe_3O_4\ +\ H_2
Число атомов Fe, H и O должно быть равным с обеих сторон
1 атом Fe на левой стороне и 3 на правой
3Fe\ +\ H_2O\ →\ Fe_3O_4\ +\ H_2
На левой стороне один атом O и 4 на правой
3Fe\ +\ 4H_2O \ →\ Fe_3O_4\ +\ 4H_2
(e) CaO\ +\ HCl\ →\ CaCl_2\ +\ H_2O
Число атомов Ca, Cl, H и O должно быть одинаковым с обеих сторон
Имеется 1 атом Cl слева и 2 справа
CaO\ +\ 2HCl\ →\ CaCl_2\ +\ H_2O
(f) Fe\ +\ Cl_2\ →\ FeCl_3
Число атомов Fe и Cl должно быть одинаковым с обеих сторон
2 атома Cl на левой стороне и 3 на правой стороне , H и O должны быть равны с обеих сторон
На левой стороне 1 атом Al, на правой 2
2Al\ +\ H_2O\ →\ Al_2O_3+\ H_2
На левой стороне 1 атом O и 3 на правой RHS
2Al\ +\ 3H_2O\ →\ Al_2O_3\ +\ 3H_2
(h) Al\ +\ H_2SO_4\ →\ Al_2\left(SO_4\right)_{3\ }+\ H_2
Кол-во атомы Al, H и SO4 должны быть равны с обеих сторон
На левой стороне 1 атом Al, на правой 2 атома
2Al\ +\ H_2SO_4\ →\ Al_2\left(SO_4\right)_{3\ }+\ H_2
На левой стороне 1 атом SO4 и 3 на RHS
2Al\ +\ 3H_2SO_4\ →\ Al_2\left(SO_4\right)_{3\ }+\ 3H_2
(i) Fe_2O_3\ +\ H_2\ →\ Fe\ +\ H_2O
Число атомов Fe, H и O должно быть одинаковым с обеих сторон
Имеется 2 атома Fe на левой стороне и 1 на правой стороне
Fe_2O_3\ +\ H_2\ →\ 2Fe\ +\ H_2O
Имеется 3 атома из O слева и 1 справа
Fe_2O_3\ +\ 3H_2\ →\ 2Fe\ +\ 3H_2O
(j) C\ +\ H_2SO_4\ →\ CO_2\ +\ H_2O\ +\ SO_2
Число атомов C, H и SO должно быть равны с обеих сторон
На левой стороне 4 атома O, на правой 5
C\ +\ 2H_2SO_4\ →\ CO_2\ +\ 2H_2O\ +\ SO_2
(k) Pb_3O_4\ →\ PbO\ +\ O_2
Количество атомов Pb и O должно быть одинаковым с обеих сторон
На левой стороне 3 атома Pb, на правой 1
Pb_3O_4\ →\ 3PbO\ +\ O_2
На стороне 4 атома O слева и 3 справа
2Pb_3O_4\ →\ 6PbO\ +\ O_2
Al\ +\ O_2\ →\ Al_2O_3
Количество атомов Al и O должно быть одинаковым с обеих сторон
На левой стороне 1 атом AL
4Al\ +\ 3O_2\ \ →\ 2Al_2O_3
(m) NO\ + \ O_2\ \ →\ NO_2
Количество атомов N и O должно быть одинаковым с обеих сторон
На левой стороне 3 атома O, а на правой 2 атома
2NO\ +\ O_2\ \ →\ 2NO_2
(n) ZnS\ +\ O_2\ \ →\ ZnO\ +\ SO_2
Количество атомов Zn, S и O должно быть одинаковым с обеих сторон
Есть 2 атома O слева и 3 справа
2ZnS\ +\ 3O_2\ \ →\ 2ZnO\ +\ 2SO_2
(o) Pb_3O_4\ +\ HCl\ \ →\ PbCl_2+\ H_2O\ +\ Cl_2
Количество атомов Pb, H, Cl и O должно быть одинаковым с обеих сторон
На левой стороне 4 атома O, а на правой 1
Pb_3O_4\ +\ 8HCl\ \ →\ PbCl_2+\ H_2O\ +\ Cl_2
Чтобы сделать атомы Pb равными,
Pb_3O_4\ +\ 8HCl\ \ →\ 3PbCl_2+\ 4H_2O\ +\ Cl_2
(p) ZnO\ +\ NaOH\ \ →\ Na_2ZnO_2\ +\ H_2O
Кол-во атомы Zn, H, Na и O должны быть равны с обеих сторон
Чтобы сделать атомы Na равными
ZnO\ +\ 2NaOH\ \ →\ Na_2ZnO_2\ +\ H_2O
(q) H_2S\ +\ Cl_2\ →\ S\ +\ HCl
Количество атомов H, S и Cl должно быть равным с обеих сторон
Чтобы сделать атомы Cl равными
H_2S\ +\ Cl_2\ →\ S\ +\ 2HCl
(r) FeCl_3\ +\ NaOH\ →\ NaCl\ +\ Fe\left(OH\right)_3
Число атомов Fe, O, H и Cl должно быть одинаковым с обеих сторон
Для получения Cl атомы равны
FeCl_3\ +\ 3NaOH\ →\ 3NaCl\ +\ Fe\left(OH\right)_3
(s) Fe_2O_3\ +\ CO\ →\ Fe\ +\ CO_2
Число атомов Fe , O & C должны быть равны с обеих сторон
Чтобы сделать атомы O равными
Fe_2O_3\ +\ 3CO\ →\ Fe\ +\ 3CO_2
Чтобы сделать атомы Fe равными
Fe_2O_3\ +\ 3CO\ →\ 2Fe \ +\ 3CO_2
(t) KHCO_3\ →\ K_2CO_2\ +\ H_2O\ +\ CO_2
Количество атомов K, O, H и C должно быть равным с обеих сторон
Чтобы сделать атомы K равными
2KHCO_3\ →\ K_2CO_2\ +\ H_2O\ +\ CO_2
(u) CuO\ +\ NH_3\ →\ Cu\ +\ H_2O\ +\ N_2
Число атомов Cu, O, H и N должно быть одинаковым с обеих сторон
Сделать атомы N равными
3CuO\ +\ 2NH_3\ →\ 3Cu\ +\ 3H_2O\ +\ N_2
Matter ICSE Class-8th Essential Chemistry Solutions Ch-1 Bharti Bhawan
Matter ICSE Class-8 Essential Chemistry Solutions Ch-1 Bharti Bhawan Publishers. Мы предоставляем пошаговый ответ на цель, верно, неверно, сопоставляем следующее, короткий / длинный ответ, тип упражнения-1 вопрос . Посетите официальный веб-сайт CISCE для получения подробной информации о ICSE Board Class-8.
Мы предоставляем пошаговый ответ на цель, верно, неверно, сопоставляем следующее, короткий / длинный ответ, тип упражнения-1 вопрос . Посетите официальный веб-сайт CISCE для получения подробной информации о ICSE Board Class-8.
| Доска | МКСЭ |
| Публикации | Издательство Бхарти Бхаван |
| Тема | Химия |
| Класс | 8-й |
| Глава-1 | Материя |
| Название книги | Основной |
| Темы | Решение задачи, Верно Неверно, Сопоставьте следующие вопросы, Короткие/Длинные вопросы типа ответа |
| Академическая сессия | 2021-2022 |
Упражнение Вопросы типа «Краткий ответ»
Страница- 5
Вопрос 1Какие существуют три состояния вещества?
Ответ:
три состояния вещества: твердое, жидкое и газообразное
Вопрос 2 Расположите твердые, жидкие и газообразные вещества в порядке увеличения межмолекулярного пространства.
Ответ:
твердые вещества < жидкости < газы
Вопрос 3Расположите твердые, жидкие и газообразные вещества в порядке возрастания межмолекулярного взаимодействия.
Ответ:
Твердые тела > жидкости > газы
Вопрос 4Что произойдет с кинетической энергией частицы, если ее нагреть?
Ответ:
увеличение
Вопрос 5Что вызывает давление газа?
Ответ :
Увеличение количества молекул газа в контейнере того же объема увеличивает давление. Уменьшение объема контейнера увеличивает давление газа. Повышение температуры газа в жестком сосуде увеличивает давление
Вопрос 6В каком состоянии вещества частицы перемещаются на самые большие расстояния?
Ответ:
Газ
Упражнение Вопросы с подробным ответом
Страница 6
Вопрос 1 Объясните плавление твердого тела на основе кинетической теории.
Ответ :
При повышении температуры твердых тел кинетическая энергия частиц увеличивается. За счет увеличения кинетической энергии частицы начинают колебаться с большей скоростью. Температура, при которой твердое тело плавится, превращаясь в жидкость при атмосферном давлении, называется точкой плавления 9.0003
Вопрос 2Объясните испарение жидкости на основе кинетической теории.
Ответ:
Согласно кинетической теории, молекулы жидкости находятся в состоянии непрерывного хаотического движения. . Такие молекулы будут свободно перемещаться в пространстве над жидкостью . Это явление испарения, которое может происходить при любой температуре
Вопрос 3Объясните сжижение газа на основе кинетической теории.
Ответ :
Молекулы в газе находятся в непрерывном движении, когда температура газа снижается, он выделяет тепло, поэтому молекулы сближаются друг с другом и, следовательно, он переходит в жидкое состояние . Весь этот процесс известен как сжижение газа
Весь этот процесс известен как сжижение газа
Объясните замерзание жидкости на основе кинетической теории.
Ответ:
При охлаждении жидкости ее молекулы теряют кинетическую энергию, и их движение замедляется. Когда они замедляются до такой степени, что силы межмолекулярного притяжения превышают силы столкновения от случайного движения, тогда происходит фазовый переход из жидкого состояния в твердое и материал замерзает.
CISCE Последние новости сегодня Нажмите здесь |
Сформулируйте закон сохранения массы.
Ответ:
Закон сохранения массы гласит, что в химической реакции масса не создается и не уничтожается . Атом углерода переходит из твердого состояния в газообразное, но его масса не меняется. Точно так же закон сохранения энергии утверждает, что количество энергии не создается и не уничтожается
Вопрос 6 Опишите эксперимент, доказывающий закон сохранения массы.
Ответ:
Экспериментальная проверка закона сохранения массы
Требования: Н-образная трубка Ландольта, раствор хлорида натрия, раствор нитрата серебра и т. д. трубка взята. В одно колено трубки набирают раствор хлорида натрия, а в другое — раствор нитрата серебра, как показано на рисунке. Обе конечности теперь запечатаны и взвешены. Теперь трубы отводят, чтобы растворы могли смешаться и вступить в химическую реакцию. Происходит реакция и выпадает белый осадок хлорида серебра.
AgNo3 + NaCl —- AgCl + NaNO3
Нитрат серебра +Хлорид натрия— Хлорид серебра+ Нитрат натрия
Пробирку снова взвешивают. Масса пробирки оказывается точно такой же, как и масса, полученная до переворачивания пробирки. Таким образом, этот эксперимент наглядно подтверждает закон сохранения массы.
Вопрос 1Какое из следующих утверждений верно:
(a) Межмолекулярное пространство является самым большим в твердом состоянии.
(b) Межмолекулярные силы наиболее сильны в твердом состоянии.
(c) Межмолекулярные силы наиболее сильны в жидком состоянии.
(d) Межмолекулярные силы наиболее сильны в газообразном состоянии.
Ответ:
(b) Межмолекулярная сила наиболее сильна в твердом состоянии.
Вопрос 2Какое из следующих утверждений неверно?
(а) Кинетическая энергия частиц уменьшается с повышением температуры
(б) Закон сохранения массы подчиняется химическим реакциям.
(c) Материя может переходить из одной формы в другую.
(г) Материя не может быть создана.
Ответ:
(а) Кинетическая энергия частиц уменьшается с повышением температуры
Заполните пропуски.
1. Межмолекулярное пространство в веществе ……. уменьшается ….. с увеличением межмолекулярной силы (увеличивается/уменьшается).
2. Испарение жидкости происходит быстрее при ……. выше …….. температуры. (выше/ниже)
3. Газ легко сжимается благодаря его …. большой …. межмолекулярное пространство. (большой/маленький)
4. Среди льда, воды и водяного пара межмолекулярная сила равна …. самый слабый … в водяном паре. (слабейший/самый сильный)
5. Кинетическая энергия частицы …. убывает … при охлаждении. (уменьшается/увеличивается)
Напишите T для истинного и «F» для ложного для следующих утверждений.
1. Жидкость не испаряется ниже точки кипения. неверно
2. Столкновение частиц в жидкости вызывает ее испарение. верно
3. При нагревании вещества кинетическая энергия частиц уменьшается. неверно
4. При нагревании твердого тела его частицы вибрируют сильнее. верно
5. Практически не происходит уменьшения общей массы веществ в химической реакции.



 Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
