ГДЗ по химии за 8 класс, Рудзитис, ФельдманПрудовое — Туристический райПрудовое
Все про сельский туризм
Статьи11.07.2014
Начиная с самых древних времен, когда наши предки впервые узнали, зачем нужен огонь – можно сказать, что уже тогда существовала химия. Разумеется, в самом упрощенном варианте, какой только можно себе представить. Никакой таблицы Менделеева, и уж тем более, ГДЗ по химии за 8 класс, Рудзитис, Фельдман, не было в помине, не было сложных названий химических элементов, и очень долго время ученые не знали, чем обернется очередной эксперимент, и ставили химические опыты на свой страх и риск.
Сегодня наши знания о химии достигли такого уровня, что вся промышленность, строительство и другие области деятельности взаимосвязаны с этой наукой. Даже если вы не планируете связать свою дальнейшую жизнь с данной сферой, знание химии будет только в плюс, ведь элементарные химические реакции мы проводим ежедневно в быту! Как избавиться от изжоги при помощи соды, наверное, знает каждый, и это далеко не единственный пример присутствия химии, как науки, в нашей жизни.
ГДЗ по химии за 8 класс, Рудзитис, Фельдман – отличный решебник, автор которого уже завоевал популярность у школьников по всей России. Доступное пошаговое изучение сложного предмета теперь возможно онлайн.
Хочу купить решебники по алгебре за 10 класс
Если вы вбили данный запрос в поисковую строку, то мы готовы сообщить вам две неожиданные новости… И обе они хорошие: первая – на сайте «Ботан» купить решебники по алгебре за 10 класс вам не удастся. Вторая – они доступны для вас бесплатно и прямо сейчас! Как видите, вы получаете возможность сэкономить денежные средства, и получить желаемое, не откладывая.
Алгебра – этот тот предмет, который ежегодно сдают все выпускники школ по всей России. И это тот предмет, о который многие «спотыкаются» на выходе из школы. Согласитесь, весьма обидно получить «неуд» на экзамене? Если бы от этого зависели только оценки в аттестате! Количество баллов, набранных на ЕГЭ, напрямую влияет на ваши шансы поступить на желаемую специальность, поэтому рисковать не стоит.
Мы предлагаем вам уникальное решение, которое станет гарантом успешной сдачи экзаменов. Просто добавьте сайт в закладки браузера, и будьте уверены, что всегда сможете найти решебники по алгебре за 10 класс буквально за пару кликов. Не стоит раньше времени паниковать и искать дорогостоящие услуги репетитора, сердиться на ребенка и упрекать его в плохой подготовке. Вы можете ему помочь – просто подскажите, где найти решебники по алгебре за 10 класс. Далее ученику просто достаточно выполнять домашние задания и сверять ответы в решебнике. Найдя ошибку, школьник легко сможет проследить логику решения самой сложной задачи.
Решебники – это не просто сборник готовых ответов, это тренажер для ума, который приучает ученика к постоянной работе, и, одновременно, гарантирует «отличные» оценки за домашние задания, ведь перед тем, как сдать тетрадь на проверку учителю, у него всегда будет возможность проверить задания самостоятельно при помощи решебника.
Читайте еще:
Didactic Capacity of Selected Czech and Russian Organic Chemistry Textbooks
Chemistry-Didactics-Ecology-Metrology
- Dettagli della rivista
- Formato
- Rivista
- eISSN
- 2084-4506
- Prima pubblicazione
- 17 января 2013 г.

- Frequenza di pubblicazione
- 2 volte all’anno
- Lingue
- Inglese
кампусы. Int Rev Res Открытое распределенное обучение. 2013;14:1-26. ДОИ: 10.19173/irrodl.v14i3.1237.10.19173/irrodl.v14i3.1237Поиск в Google Scholar
[2] Gurung RAR, Martin CR. Прогнозирование чтения учебника. Учить психологию. 2011;38:22-8. DOI: 10.1177/00986283103.10.1177/00986283103Поиск в Google Scholar
[3] Kim JHY, Jung HY. Южнокорейский проект цифровых учебников. Компьютеры в школах. 2010;27:247-65. DOI: 10.1080/07380569.2010.523887.10.1080/07380569.2010.523887Поиск в Google Scholar
[4] Сунарко В., Харо Н., Ситорус И.Т., Ситорус П.А., Сарагих Е. Контент-анализ учебника английского языка «Радостный» для начальных классов II. ДЖИ. 2019;4:77-88. DOI: 10.31327/jee.v4i2.1107.10.31327/jee.v4i2.1107Поиск в Google Scholar
[5] Abd-El-Khalick F, Myers JY, Summers R, Brunner J, Waight N, Wahbeh N, et al. Продольный анализ степени и способа представления природы науки в учебниках биологии и физики для средней школы США. J Res Sci Teach. 2017;54:82-120. DOI: 10.1002/tea.21339.10.1002/tea.21339Поиск в Google Scholar
J Res Sci Teach. 2017;54:82-120. DOI: 10.1002/tea.21339.10.1002/tea.21339Поиск в Google Scholar
[6] Birema AM, Schwartz RS, Gill SA. Насколько совпадают современные научные исследования и содержание учебников? Методология и тематическое исследование. Преподавание J Res Sci. 2017; 54:1097-118. DOI: 10.1002/tea.21399.10.1002/tea.21399Search in Google Scholar
[7] Пруча Ю. Учебнице: Теория анализа образовательных медиа. Брно: Пайдо; 1998. ISBN: 8085931494. Поиск в Google Scholar
[8] Деветак И., Вогринц Дж. Критерии оценки качества научных учебников. Критический анализ учебников по естественным наукам. Дордрехт: Springer, Нидерланды; 2013. ISBN: 9789400741676.10.1007/978-94-007-4168-3_1Поиск в Google Scholar
[9] Вестеринен В.М., Аксела М., Лавонен Дж. Количественный анализ представлений о природе науки в скандинавских учебниках для старших классов средней школы с использованием системы анализа, основанной на философии химии. научн. образование. 2013; 22:1839-55. DOI: 10.1007/s11191-011-9400-1.10.1007/s11191-011-9400-1Search in Google Scholar
DOI: 10.1007/s11191-011-9400-1.10.1007/s11191-011-9400-1Search in Google Scholar
[10] Яноушкова Е. Взять за основу дидактическую выбавленность и мировую облигацию и степень сложности текста современных учебников). Прага: Педагогическая направленность. 2009 г.;19:56-72.Search in Google Scholar
[11] Maňák J, Knecht P. Hodnocení učebnic (Оценка учебников). Брно: Пайдо; 2007. ISBN: 9788073151485. Поиск в Google Scholar
[12] Цирер К. Учебники по дидактике в Германии и США: исследование эклектики, отбора и интеграции. Res Comparative Internat Educ. 2011;62:147-60. DOI: 10.2304/rcie.2011.6.2.147.10.2304/rcie.2011.6.2.147Search in Google Scholar
[13] Фризен Н. Прошлое и вероятное будущее образовательной формы: Случай из учебника. Образовательные рез. 2013;42:498-508. DOI: 10.3102/0013189X13513535.10.3102/0013189X13513535Search in Google Scholar
[14] Ибрагимов И.Д., Дусенко С.В., Хайрулина Е.Р., Тихонова Н.В., Евграфова О.Г. Рекомендации по созданию учебников как информационно-методических средств управления образованием. Int Elect J Math Ed. 2016;11:33-446. Доступно по ссылке: https://www.iejme.com/article/recommendations-on-the-textbooks-creation-as-information-and-teaching-tools-of-education-management.10.29333/iejme/343Поиск в Google Scholar
Int Elect J Math Ed. 2016;11:33-446. Доступно по ссылке: https://www.iejme.com/article/recommendations-on-the-textbooks-creation-as-information-and-teaching-tools-of-education-management.10.29333/iejme/343Поиск в Google Scholar
[15] Берри Т., Кук Л., Хилл Н., Стивенс К. Исследовательский анализ использования учебников и учебных привычек: заблуждения и препятствия на пути к успеху. Преподавать в колледже. 2010;59:31-9. DOI: 10.1080/87567555.2010.509376.10.1080/87567555.2010.509376Поиск в Google Scholar
[16] Фостер С. Доминирующие традиции в международных исследованиях и пересмотре учебников. Запрос образования. 2016;2:5-20. DOI: 10.3402/edui.v2i1.21959.10.3402/edui.v2i1.21959Поиск в Google Scholar
[17] Mohd SH. Анализ учебника EFL: тематическое исследование. Язык и грамотность. 2012;14:27-45. DOI: 10.20360/G2HP4J.10.20360/G2HP4JПоиск в Google Scholar
[18] Цветков Л.А. Органическая химия: учебник для учащихся 10-11 классов. Москва: Гуманитарный издательский центр Владос; 2013. ISBN: 97856660. Поиск в Google Scholar
ISBN: 97856660. Поиск в Google Scholar
[19] Габриелян О.О. Химия: 10 класс, 18-е (Химия: 10 класс, 18-й). Москва: Дрофа; 2011. ISBN: 978535814007-3. Поиск в Google Scholar
[20] Коларж К., Кодичек М. Хеми II. pro gymnázia — Organická chemie a biochemie (Химия II. Для гимназий — органическая химия и биохимия). Прага: СПН — Педагогическое издательство; 2005. ISBN: 8072352830. Поиск в Google Scholar
[21] Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия 10 класс. Москва: Просвещение; 2012. ISBN: 97850164. Поиск в Google Scholar
[22] Viehhauser M. Das Schulwesen aber ist und bleibt allezeit ein politikum (Но школьная система есть и всегда будет политическим вопросом): Постановление об общей школе Фельбигера и школьная реформа в Габсбургской монархии XVIII в. Вестберг Дж., Бозер Л., Брювилер И., редакторы. Школьные акты и рост массового обучения. Чам: Springer International Publishing; 2019. ISBN: 9783030135690.10.1007/978-3-030-13570-6_2Поиск в Google Scholar
[23] Маклеод М. , Сумиллера Р.Г., Сурман Дж., Смирнова Э. Язык как научный инструмент: формирование научного языка во времени и в национальных традициях. Нью-Йорк: Routledge, Taylor Francis Group; 2016. ISBN: 9781138101050.10.4324/9781315657257 Поиск в Google Scholar
, Сумиллера Р.Г., Сурман Дж., Смирнова Э. Язык как научный инструмент: формирование научного языка во времени и в национальных традициях. Нью-Йорк: Routledge, Taylor Francis Group; 2016. ISBN: 9781138101050.10.4324/9781315657257 Поиск в Google Scholar
[24] Quadrát BB. Základové chemie: K užívání na nižších reálkách (Основная химия: для использования в младших классах средней школы). Брно: Тискем Карла Виникера; 1862.Поиск в Google Scholar
[25] Ян З., Прохазка П. Химия органическая или химия соединений углерода. Прага; 1878.Поиск в Google Scholar
[26] Червены А. Закладовы лучи господаржске. Прага; 1868.Поиск в Google Scholar
[27] Сметана Ф.Дж. Počátkové silozpytu čili fysiky pro nižší gymnasia a realky (Начало «силозпыта» или физики для младших гимназий и средних школ). Прага: JG Calve. 1852.Поиск в Google Scholar
[28] Хуварова М. Самые популярные учебники химии для средней школы в гимназиях. Оломоуц: Университет Палацкого в Оломоуце; 2010. Поиск в Google Scholar
[29] Vacík J. Přehled středoškolské chemie (Обзор химии в средней школе). Прага: СПН — Педагогическое издательство; 1999. ISBN: 9788085937084. Поиск в Google Scholar
Přehled středoškolské chemie (Обзор химии в средней школе). Прага: СПН — Педагогическое издательство; 1999. ISBN: 9788085937084. Поиск в Google Scholar
[30] Чтрнацтова Х. Учебные задачи по химии. Прага: Каролинум; 2009 г.. ISBN: 8071847070. Поиск в Google Scholar
[31] Телешов В.С. Оснащение кабинетов химии в Российской Империи XIX — начале XX вв. Санкт-Петербург: Gamtamokslinis ugdymas Bendrojo ugdymo mokykloje. 2017;23:125-36.10.48127/gu/17.23.125Search in Google Scholar
[32] Караскова Н, Коларж К. Верховский Вадим Никандрович и его вклад в химическое образование (Вадим Никандрович Верховский и его вклад в химическое образование) . In: Co w dydaktykach nauk przyrodniczych ocalić od zapomnienia? (Что спасти в дидактике естествознания от забвения?) Kraków: Uniwersytet Pedagogiczny w Krakowie; 2015. ISBN: 9.788372719676.Search in Google Scholar
[33] Клечка М. Теория и практика создания учебников химии для средних школ. Прага: Карлов университет; 2011. Поиск в Google Scholar
[34] Маречек А. , Гонза Дж. Chemie pro čtyřletá gymnázia — 3 díl (Химия для четырехлетних гимназий -3 rd том). Оломоуц: Издательство Оломоуца; 2000. ISBN: 97880
, Гонза Дж. Chemie pro čtyřletá gymnázia — 3 díl (Химия для четырехлетних гимназий -3 rd том). Оломоуц: Издательство Оломоуца; 2000. ISBN: 97880
Закономерности изменения электроотрицательности элементов в группе и периоде. Закономерности изменения электроотрицательности элементов в группе и периоде Электроотрицательность химических элементов уменьшается в ряду
Периодическая таблица химических элементов Д. И. Менделеева представляет собой классификацию химических элементов в виде таблицы, в которой отчетливо видна зависимость различных свойств элементов от заряда атомного ядра. Эта система является графическим изображением периодического закона, установленного русским химиком Д.И.Менделеевым в 1869 г. Она была создана им в 1869-1871 гг. Таблица состоит из столбцов (групп) и строк (периодов). Группы определяют основные физико-химические свойства элементов в связи с одинаковыми электронными конфигурациями на внешних электронных оболочках. В периоды химические элементы также располагаются в определенном порядке: заряд ядра увеличивается, а внешняя электронная оболочка заполняется электронами. Хотя для групп характерны более значимые тренды и закономерности, есть области, где горизонтальное направление более значимо и показательно, чем вертикальное. Имеется в виду блок лантаноидов и актинидов.
В периоды химические элементы также располагаются в определенном порядке: заряд ядра увеличивается, а внешняя электронная оболочка заполняется электронами. Хотя для групп характерны более значимые тренды и закономерности, есть области, где горизонтальное направление более значимо и показательно, чем вертикальное. Имеется в виду блок лантаноидов и актинидов.
Понятие электроотрицательности
Электроотрицательность — это фундаментальное химическое свойство атома. Этот термин обозначает относительную способность атомов в молекуле отрывать общие электронные пары. Электроотрицательность определяет тип и свойства химической связи и тем самым влияет на характер взаимодействия между атомами в химических реакциях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), а самая низкая у активных металлов (I группа). Современное понятие ввел американский химик Л. Полинг. Теоретическое определение электроотрицательности предложил американский физик Р. Малликен.
Малликен.
Электроотрицательность химических элементов в периодической системе Д. И. Менделеева возрастает по периоду слева направо, а в группах — снизу вверх. Электроотрицательность зависит от:
- атомного радиуса;
- количество электронов и электронных оболочек;
- энергии ионизации.
Итак, в направлении слева направо радиус атомов обычно уменьшается из-за того, что каждый последующий элемент имеет увеличение количества заряженных частиц, поэтому электроны притягиваются сильнее и ближе к ядру. Это приводит к увеличению энергии ионизации, так как прочная связь в атоме требует большей энергии для отрыва электрона. Соответственно увеличивается и электроотрицательность.
Активность простых веществ можно узнать с помощью таблицы электроотрицательности химических элементов. Обозначается как х. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью.
Все активные простые вещества можно разделить на две группы по физико-химическим свойствам:
- металлы;
- неметаллы.
Все металлы являются восстановителями. В реакциях они отдают электроны и имеют положительную степень окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.
Рис. 1. Действия окислителей и восстановителей в реакциях.
Полинг составил шкалу электроотрицательности. По шкале Полинга наибольшую электроотрицательность имеет фтор (4), наименьшую — франций (0,7). Это означает, что фтор является сильнейшим окислителем и способен притягивать электроны от большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдавать, а не получать электроны.
Электроотрицательность является одним из основных факторов, определяющих тип и свойства химической связи, образующейся между атомами.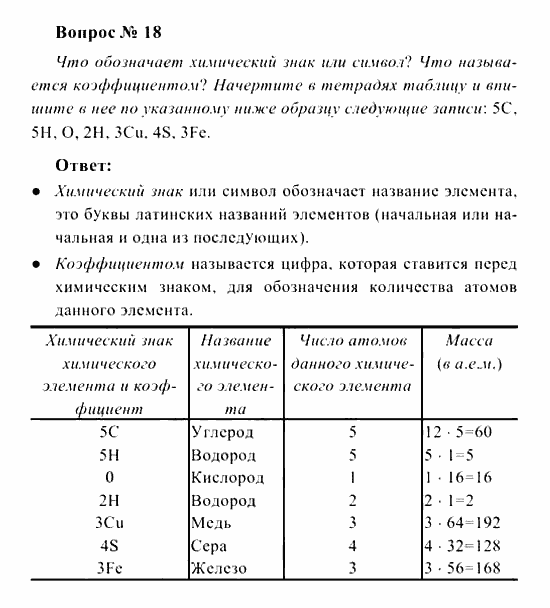
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. По шкале элементы со значением больше двух являются окислителями и проявляют свойства типичного неметалла.
Артикул | Элемент | Символ | Электроотрицательность |
Стронций | |||
Иттербий | |||
Празеодим | |||
Прометей | |||
Америций | |||
Гадолиний | |||
Диспрозий | |||
Плутоний | |||
Калифорния | |||
Эйнштейний | |||
Менделевий | |||
Цирконий | |||
Нептуний | |||
Протактиний | |||
Марганец | |||
Бериллий | |||
Алюминий | |||
Технеций | |||
Молибден | |||
Палладий | |||
Вольфрам | |||
Кислород | |||
Вещества с электроотрицательностью два или менее являются восстановителями и проявляют свойства металлов. Переходные металлы с переменной степенью окисления и относящиеся к боковым подгруппам таблицы Менделеева имеют значения электроотрицательности в пределах 1,5-2. Элементы с электроотрицательностью, равной или меньшей единицы, обладают ярко выраженными свойствами восстановителя. Это типичные металлы.
Переходные металлы с переменной степенью окисления и относящиеся к боковым подгруппам таблицы Менделеева имеют значения электроотрицательности в пределах 1,5-2. Элементы с электроотрицательностью, равной или меньшей единицы, обладают ярко выраженными свойствами восстановителя. Это типичные металлы.
В ряду электроотрицательности металлические и восстановительные свойства возрастают справа налево, а окислительные и неметаллические — слева направо.
Рис. 2. Ряд электроотрицательностей.
Помимо шкалы Полинга узнать, насколько выраженными могут быть окислительные или восстановительные свойства элемента, можно с помощью таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Рис. 3. Таблица Менделеева.
Чему мы научились?
Электроотрицательность указывает на способность элементов отдавать или получать электроны. Эта характеристика помогает понять, насколько ярко выражены свойства окислителя (неметалла) или восстановителя (металла) у того или иного элемента. Для удобства Полинг разработал шкалу электроотрицательности. По шкале фтор обладает максимальными окислительными свойствами, а франций — минимальными. В периодической таблице свойства металлов возрастают справа налево и сверху вниз.
Эта характеристика помогает понять, насколько ярко выражены свойства окислителя (неметалла) или восстановителя (металла) у того или иного элемента. Для удобства Полинг разработал шкалу электроотрицательности. По шкале фтор обладает максимальными окислительными свойствами, а франций — минимальными. В периодической таблице свойства металлов возрастают справа налево и сверху вниз.
Тест по теме
Оценка доклада
Средняя оценка: 4,6. Всего полученных оценок: 117.
На этом занятии вы узнаете о закономерностях изменения электроотрицательности элементов в группе и периоде. На ней вы рассмотрите, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучите закономерности изменения электроотрицательности элемента.
Тема: Химическая связь. Электролитическая диссоциация
Занятие: Закономерности изменения электроотрицательности химических элементов в группе и периоде
1. Закономерности изменения значений электроотрицательности в периоде
Закономерности изменения значений электроотрицательности в периоде Закономерности изменения значений электроотрицательности в периоде относительной электроотрицательности в периоде
Рассмотрим на примере элементов второго периода закономерности изменения значений их относительной электроотрицательности. Рис. 1.
Рис. 1. Закономерности изменения значений электроотрицательности элементов 2 периода
Относительная электроотрицательность химического элемента зависит от заряда ядра и от радиуса атома. Во второй период входят элементы: Li, Be, B, C, N, O, F, Ne. От лития к фтору увеличивается заряд ядра и количество внешних электронов. Количество электронных слоев остается неизменным. Это означает, что сила притяжения внешних электронов к ядру увеличится, и атом как бы сожмется. Радиус атома от лития до фтора уменьшится. Чем меньше радиус атома, тем сильнее внешние электроны притягиваются к ядру, а значит, больше значение относительной электроотрицательности.
В период с увеличением заряда ядра радиус атома уменьшается, а значение относительной электроотрицательности увеличивается.
Рис. 2. Закономерности изменения значений электроотрицательности элементов VII-А группы.
2. Закономерности изменения значений электроотрицательности в группеЗакономерности изменения значений относительной электроотрицательности в основных подгруппах
Рассмотрим закономерности изменения значений относительной электроотрицательности в основных подгруппах на примере элементов VII-А группы. Рис. 2. В седьмой группе основную подгруппу составляют галогены: F, Cl, Br, I, At. На внешнем электронном слое эти элементы имеют одинаковое число электронов — 7. С увеличением заряда атомного ядра при переходе от периода к периоду увеличивается число электронных слоев, а значит, увеличивается и радиус атома. Чем меньше радиус атома, тем больше значение электроотрицательности.
В основной подгруппе с увеличением заряда атомного ядра радиус атома увеличивается, а значение относительной электроотрицательности уменьшается.
Так как химический элемент фтор расположен в верхнем правом углу Периодической таблицы Менделеева, его значение относительной электроотрицательности будет максимальным и численно равным 4.
Вывод: Относительная электроотрицательность увеличивается с уменьшением атомного радиуса.
В периоды с увеличением заряда атомного ядра увеличивается электроотрицательность.
В основных подгруппах с увеличением заряда атомного ядра уменьшается относительная электроотрицательность химического элемента. Наиболее электроотрицательным химическим элементом является фтор, так как он расположен в правом верхнем углу Периодической таблицы Д. И. Менделеева.
Краткое содержание урока
На этом уроке вы узнали о закономерностях изменения электроотрицательности элементов в группе и периоде. На ней вы рассмотрели, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучены закономерности изменения электроотрицательности элемента.
1. Рудзитис Г. Э. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Э. Рудзитис, Ф. Г. Фельдман. М.: Образование. 2011. 176с.: ил.
2. Попель П. П. Химия: 8 класс: учебник для общеобразовательных учреждений / П. П. Попель, Л. С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.: 2001. 224с.
1. Чемпорт. ру.
1. №№ 1,2,5 (стр. 145) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Э. Рудзитис, Ф. Г. Фельдман. М.: Образование. 2011 176с.: ил.
2. Приведите примеры веществ с неполярными ковалентными и ионными связями. Каково значение электроотрицательности в образовании таких соединений?
3. Расположить в порядке возрастания электроотрицательности элементы второй группы главной подгруппы.
На этом уроке вы узнаете о закономерностях изменения электроотрицательности элементов в группе и периоде. На ней вы рассмотрите, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучите закономерности изменения электроотрицательности элемента.
На ней вы рассмотрите, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучите закономерности изменения электроотрицательности элемента.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Закономерности изменения электроотрицательности химических элементов в группе и периоде
Закономерности изменения значений относительной электроотрицательности в периоде
9004 Рассмотрим на примере элементы второго периода, закономерности изменения значений их относительной электроотрицательности. Рис. 1.Рис. 1. Закономерности изменения значений электроотрицательности элементов 2 периода
Относительная электроотрицательность химического элемента зависит от заряда ядра и от радиуса атома. Во втором периоде элементов: Li, Be, B, C, N, O, F, Ne. От лития к фтору увеличивается заряд ядра и количество внешних электронов. Количество электронных слоев остается неизменным. Это означает, что сила притяжения внешних электронов к ядру увеличится, и атом как бы сожмется. Радиус атома от лития до фтора уменьшится. Чем меньше радиус атома, тем сильнее внешние электроны притягиваются к ядру, а значит, больше значение относительной электроотрицательности.
Это означает, что сила притяжения внешних электронов к ядру увеличится, и атом как бы сожмется. Радиус атома от лития до фтора уменьшится. Чем меньше радиус атома, тем сильнее внешние электроны притягиваются к ядру, а значит, больше значение относительной электроотрицательности.
В период с увеличением заряда ядра радиус атома уменьшается, а значение относительной электроотрицательности увеличивается.
Рис. 2. Закономерности изменения значений электроотрицательности элементов VII-А группы.
Закономерности изменения значений относительной электроотрицательности в основных подгруппах
Рассмотрим закономерности изменения значений относительной электроотрицательности в основных подгруппах на примере элементов VII-А группа. Рис. 2. В седьмой группе основную подгруппу составляют галогены: F, Cl, Br, I, At. На внешнем электронном слое эти элементы имеют одинаковое число электронов — 7. С увеличением заряда атомного ядра при переходе от периода к периоду увеличивается число электронных слоев, а значит, увеличивается и радиус атома. Чем меньше радиус атома, тем больше значение электроотрицательности.
Чем меньше радиус атома, тем больше значение электроотрицательности.
В основной подгруппе с увеличением заряда атомного ядра радиус атома увеличивается, а значение относительной электроотрицательности уменьшается.
Поскольку химический элемент фтор расположен в правом верхнем углу таблицы Менделеева, его значение относительной электроотрицательности будет максимальным и численно равным 4.
Вывод: Относительная электроотрицательность увеличивается с уменьшением атомного радиуса.
В периоды с увеличением заряда атомного ядра увеличивается электроотрицательность.
В основных подгруппах с увеличением заряда атомного ядра уменьшается относительная электроотрицательность химического элемента. Наиболее электроотрицательным химическим элементом является фтор, так как он расположен в правом верхнем углу периодической таблицы Менделеева.
Итог урока
На этом уроке вы узнали о закономерностях изменения электроотрицательности элементов в группе и периоде. На ней вы рассмотрели, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучены закономерности изменения электроотрицательности элемента.
На ней вы рассмотрели, от чего зависит электроотрицательность химических элементов. На примере элементов второго периода изучены закономерности изменения электроотрицательности элемента.
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. М.: Образование. 2011. 176с.: ил.
2. Попель П.П. Химия: 8 класс: учебник для общеобразовательных учреждений / ПП. Попель, Л.С. Кривля. -К.: ИЦ «Академия», 2008. — 240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.: 2001. 224с.
1.№ 1,2,5 (с.145) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. М.: Образование. 2011 176с.: ил.
2. Приведите примеры веществ с неполярными ковалентными и ионными связями. Каково значение электроотрицательности в образовании таких соединений?
3. Расположить в порядке возрастания электроотрицательности элементы второй группы главной подгруппы.
При взаимодействии элементов электронные пары образуются за счет принятия или высвобождения электронов. Способность атома оттягивать электроны Лайнус Полинг назвал электроотрицательностью химических элементов. Полинг составил шкалу электроотрицательности элементов от 0,7 до 4,9.0019
Что такое электроотрицательность?
Электроотрицательность (ЭО) — количественная характеристика элемента, показывающая, насколько сильно электроны притягиваются к ядру атома. ЭО также характеризует способность удерживать валентные электроны на внешнем энергетическом уровне.
Рис. 1. Строение атома.
Способность отдавать или получать электроны определяет принадлежность элементов к металлам или неметаллам. Элементы, легко отдающие электроны, обладают ярко выраженными металлическими свойствами. Элементы, принимающие электроны, обладают неметаллическими свойствами.
Электроотрицательность проявляется в химических соединениях и показывает смещение электронов в сторону одного из элементов.
Электроотрицательность увеличивается слева направо и уменьшается сверху вниз в периодической таблице.
Как определить
Значение можно определить по таблице электроотрицательности химических элементов или шкале Полинга. За единицу принята электроотрицательность лития.
Окислители и галогены имеют самый высокий ЭО. Их электроотрицательность больше двух. Рекордсменом является фтор с электроотрицательностью 4,9.0019
Рис. 2. Таблица электроотрицательности.
Самые маленькие ЭО (менее двух) имеют металлы первой группы таблицы Менделеева. Активными металлами являются натрий, литий, калий, так как им легче расстаться с одним валентным электроном, чем принять недостающие электроны.
Некоторые элементы находятся между ними. Их электроотрицательность близка к двум. Такие элементы (Si, B, As, Ge, Te) проявляют металлические и неметаллические свойства.
Для удобства сравнения ЭО используется ряд электроотрицательностей элементов. Слева металлы, справа неметаллы. Чем ближе к краям, тем активнее элемент. Самым сильным восстановителем, легко отдающим электроны и обладающим наименьшей электроотрицательностью, является цезий. Фтор является активным окислителем, способным притягивать электроны.
Слева металлы, справа неметаллы. Чем ближе к краям, тем активнее элемент. Самым сильным восстановителем, легко отдающим электроны и обладающим наименьшей электроотрицательностью, является цезий. Фтор является активным окислителем, способным притягивать электроны.
Рис. 3. Ряд электроотрицательностей.
В неметаллических соединениях элементы с более высоким EO притягивают электроны. Кислород с электроотрицательностью 3,5 притягивает атомы углерода и серы с электроотрицательностью 2,5.
Чему мы научились?
Электроотрицательность указывает на степень удержания валентных электронов ядром атома. В зависимости от значения ЭО элементы способны отдавать или принимать электроны. Элементы с более высокой электроотрицательностью притягивают электроны и проявляют неметаллические свойства. Элементы, атомы которых легко отдают электроны, обладают металлическими свойствами. Некоторые элементы имеют условно нейтральный ЭО (около двух) и могут проявлять металлические и неметаллические свойства.


