ГДЗ по химии 8 класс Габрусева рабочая тетрадь
ГДЗ готовые домашние задания к рабочей тетради по химии 8 класс Габрусева ФГОС от Путина. Решебник (ответы на вопросы и задания) учебников и рабочих тетрадей необходим для проверки правильности домашних заданий без скачивания онлайн
Выберите номер задания Рабочей тетради
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 41 43 44 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89
Тестовые задания по теме — Первоначальные химические понятия
I вариант
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
II вариант
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107
Тестовые задания по теме — Кислород. Горение
I вариант
1 2 3 4 5 6 7 8 9 10 11 12
II вариант
1 2 3 4 5 6 7 8 9 10 11 12
108 109 110 111 112 113 114
Тестовые задания по теме — Водород
I вариант
1 2 3 4 5 6 7 8 9 10 11 12
II вариант
1 2 3 4 5 6 7 8 9 10 12
115 116 117 118 119 120 121 122 123 124 125 126
Тестовые задания по теме — Растворы.
 Вода
ВодаI вариант
1 2 3 4 5 6 7 8 9 10 11 12
II вариант
1 2 3 4 5 6 7 8 9 10 11 12
127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 174 175 176 177
Тестовые задания по теме — Обобщение сведений о важнейших классах неорганических соединений
I вариант
1 2 3 4 5 6 7 8 9 10 11 12
II вариант
1 2 3 4 5 6 7 8 9
178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198
Тестовые задания по теме — Периодический закон и периодическая таблица химических элементов Д.И. Менделеева. Строение атома
I вариант
1 2 3 4 5 6 7 8 9 10 11 12 13 14
II вариант
1 2 3 4 5 6 7 8 9 10 11 12 13 14
199 200 201 202 203 204 205 206 207 208 209 210 213 214 215 217 218
Химия 8 класс. Тесты, тренажеры, контрольные работы
Тесты и тренажеры по химииКонтрольные работы по химииУМК Габриелян — Павлова. Контр. и самост. работы по химии: 8 класс.
Контр. и самост. работы по химии: 8 класс.
УМК Габриелян — Ястребова. Поурочные планы по химии 8кл.
К любому УМК — Добротин. Химия 8. Контрольные работы в новом формате (итоговая КР)
Химия 8 класс. Основные темыВведение
§ 1. Химия — часть естествознания
§ 2. Предмет химии. Вещества
§ 3. Превращения веществ. Роль химии в жизни человека
§ 4. Краткий очерк о истории развития химии
§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
§ 6. Химические формулы. Относительная атомная и молекулярная массы
Глава первая. Атомы химических элементов
§ 7. Основные сведения о строении атомов
§ 8. Изменения в составе ядер атомов химических элементов. Изотопы
§ 9. Строение электронных оболочек атомов
§ 10. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
 Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой§ 12. Ковалентная полярная химическая связь
§ 13. Металлическая химическая связь
Глава вторая. Простые вещества
§ 14. Простые вещества — металлы
§ 15. Простые вещества — неметаллы
§ 16. Количество вещества
§ 17. Молярный объём газов
Глава третья. Соединения химических элементов
§ 18. Степень окисления
§ 19. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения
§ 20. Основания
§ 21. Кислоты
§ 22. Соли
§ 23. Кристаллические решётки
§ 24. Чистые вещества и смеси
§ 25. Массовая и объёмная доли компонентов смеси (раствора)
Глава четвёртая. Изменения, происходящие с веществами
§ 26. Физические явления в химии
§ 27. Химические реакции
§ 29. Расчёты по химическим уравнениям
§ 30. Реакции разложения
§ 31. Реакции соединения
§ 32. Реакции замещения
§ 33.
 Реакция обмена
Реакция обмена§ 34. Типы химических реакций на примере свойств воды
Глава пятая. Растворение. Растворы. Реакции ионного обмена
§ 35. Растворение. Растворимость веществ в воде
§ 36. Электролитическая диссоциация
§ 37. Основные положения теории электролитической диссоциации
§ 38. Ионные уравнения
§ 39. Кислоты, их классификация и свойства
§ 40. Основания, их классификация и свойства
§ 41. Оксиды, их классификация и свойства
§ 42. Соли, их классификация и свойства
§ 43. Генетическая связь между классами веществ
§ 44. Окислительно-восстановительные реакции
Рекомендуемые материалы для очного контроля знаний
по предмету «Химия 8 класс»:
- Контрольно-измерительные материалы по химии 8 класс / Н.П.Троегубова, Е.Н.Стрельникова — М.:ВАКО, 2016
- Химия. 8 класс. Тетрадь для оценки качества знаний. Габриелян О.С., Купцова А.В. (2015, 112с.)
- Химия. 8 класс. Контрольные и проверочные работы.
 Габриелян О.С. и др. (2014, 224с.)
Габриелян О.С. и др. (2014, 224с.) - Химия в тестах, задачах, упражнениях. 8 класс. Габриелян О.С., Смирнова Т.В., Сладков С.А. (2014, 224с.)
- Контрольные и самостоятельные работы по химии. 8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.)
- Тесты по химии. 8 класс. Первоначальные химические понятия… К учебнику Рудзитиса Г.Е., … (2013, 144с.)
- Тесты по химии. 8 класс. Периодический закон и периодическая система… К учебнику Рудзитиса Г.Е., …(2013, 96с.)
- Химия 8 класс. Тесты. В 2 ч. Ким Е.П. (2011; 64с., 64с.)
- Химия 8 класс. Экспресс-диагностика. Расулова Г.Л. (2014, 112с.)
Перейти на Главную страницу сайта.
Химия 8 класс — параграф 40 вопрос 4 Габриелян, ГДЗ, решебник онлайн
Автор:
Габриелян О. С.
С.Издательство:
Дрофа
ГДЗ(готовые домашние задания), решебник онлайн по химии за 8 класс автор Габриелян параграф 40, вопрос 4 — вариант ответа на вопрос 4
Введение:
- §1. Химия — часть естествознания:
1
2
3
4
5
§2. Предмет химии. Вещества:
1
2
3
4
5
6
7
8
9
10
§3. Превращения веществ. Роль химии в жизни человека:
1
2
3
4
5
§4.

Глава Первая. Атомы химических элементов:
- §7. Основные сведения о строении атомов:
1
2
3
4
5
6
7
§8.
 Изменения в составе ядер атомов химических элементов. Изотопы:
1
2
3
4
5
6
§9. Строение электронных оболочек атомов:
1
2
3
4
5
6
7
8
§10. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов:
1
2
3
4
§11. Взаимодействие атомов элементов-неметаллов между собой:
1
2
3
4
5
§12. Ковалентная полярная химическая связь:
1
2
3
4
5
6
§13.
Изменения в составе ядер атомов химических элементов. Изотопы:
1
2
3
4
5
6
§9. Строение электронных оболочек атомов:
1
2
3
4
5
6
7
8
§10. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов:
1
2
3
4
§11. Взаимодействие атомов элементов-неметаллов между собой:
1
2
3
4
5
§12. Ковалентная полярная химическая связь:
1
2
3
4
5
6
§13.
Глава Вторая. Простые вещества:
- §14. Простые вещества-металлы:
1
2
3
4
5
§15. Простые вещества-неметаллы:
1
2
3
4
5
§16. Количество вещества:
1
2
3
4
5
§17. Молярный объем газов:
1
2
3
4
5
Глава Третья. Соединения химических элементов:
- §18. Степень окисления:
1
2
3
4
5
6
7
§19.

Глава Четвёртая.
 Изменения, происходящие с веществами:
Изменения, происходящие с веществами:- §26. Физические явления в химии:
1
2
3
4
5
6
§27. Химические реакции:
1
2
3
4
5
6
§28. Химические уравнения:
1
2
3
4
§29. Расчеты по химическим уравнениям:
1
2
3
4
5
§30. Реакции разложения:
1
2
3
4
5
6
§31. Реакции соединения:
1
2
3
4
5
6
7
8
§32.
 Реакции замещения:
1
2
3
4
5
§33. Реакции обмена:
1
2
3
4
5
6
§34. Типы химических реакций на примере свойств воды:
1
2
3
4
5
Реакции замещения:
1
2
3
4
5
§33. Реакции обмена:
1
2
3
4
5
6
§34. Типы химических реакций на примере свойств воды:
1
2
3
4
5Глава Пятая. Растворение. Растворы. Реакции ионного обмена и окислительно — восстановительные реакции:
- §35. Растворение. Растворимость веществ в воде:
1
2
3
4
5
6
7
§36. Электролитическая диссоциация:
1
2
3
4
5
§37.
 Основные положения теории электролитической:
1
2
3
4
5
6
§38. Ионные уравнения:
1
2
3
4
5
§39. Кислоты, их классификация и свойства:
1
2
3
4
5
6
§40. Основания, их классификация и свойства:
1
2
3
4
5
6
§41. Оксиды, их классификация и свойства:
1
2
3
4
5
§42.
Основные положения теории электролитической:
1
2
3
4
5
6
§38. Ионные уравнения:
1
2
3
4
5
§39. Кислоты, их классификация и свойства:
1
2
3
4
5
6
§40. Основания, их классификация и свойства:
1
2
3
4
5
6
§41. Оксиды, их классификация и свойства:
1
2
3
4
5
§42..jpg) Соли, их классификация и свойства:
1
2
3
4
5
§43. Генетическая связь между классами веществ:
1
2
3
4
5
§44. Окислительно-восстановительные реакции:
1
2
3
4
5
6
7
8
Соли, их классификация и свойства:
1
2
3
4
5
§43. Генетическая связь между классами веществ:
1
2
3
4
5
§44. Окислительно-восстановительные реакции:
1
2
3
4
5
6
7
8Практические работы:
ГДЗ, Ответы по Химии 8 класс. Рудзитис, Фельдман. Все решебники тут GDZ-na5.info
Готовые Домашние Задания, Решебник по Химии 8 класс. Рудзитис, Фельдман
ГДЗ: 8 класс. Химия. Рудзитис, Фельдман. 2017 г. |
В 8 классе школьников ждет новый предмет — химия. Для кого-то эта наука может показаться сложной. Но если в ней разобраться как следует, то сложностей она не вызовет.
Для того, чтобы изучение химии не вызывало сложностей, можно воспользоваться ГДЗ по химии для 8 класса. При тщательном и вдумчивом переписывании задания в голове будут откладываться необходимые знания и применяемые формулы. Когда у ребенка будет получаться решать химические задачи, то эта наука у него вызовет интерес и понравится. А когда предмет интересен, то и его изучение будет в удовольствие.
Таким образом, решебник не только поможет с выполнением домашней работы, но и привьет интерес к учебе.
Ответы к домашним заданиям по Химии 8 класс. Рудзитис, Фельдман
§01.
§02.
§03.
§04.
§05.
§06.
§07.
§08.
§09.
§10.
§11.
§12.
§13.
§14.
§15.
§16.
§17.
§18.
§19.
§20.
§21.
§22.
§23.
§24.
§25.
§26.
§27.
§28.
§29.
§30.
§31.
§32.
§33.
§34.
§35.
§36.
§37.
§38.
§39.
§40.
§41.
§42.
§43.
§44.
§45.

§46.
§47.
§48.
§49.
§50.
§51.
§52.
§53.
§54.
§55.
§56.
§57.
Игра по химии «ХимикУМ» – разработки уроков по химии – Корпорация Российский учебник (издательство Дрофа – Вентана)
Автор — Наговицына Ирина Сергеевна, учитель биологии и химии МБОУ «Средняя общеобразовательная школа №3» г. Абакана, Республика ХакасияЦель: расширение кругозора учащихся, стимулирование мотивации к изучению химии через занимательные опыты, викторину, загадки, которые, в свою очередь, способствуют развитию творческих способностей учащихся.
Задачи:
- Образовательная: обобщить и систематизировать знания учащихся по курсу 8 класса.

- Развивающая: развивать познавательную активность учащихся, совершенствовать навыки и умение учащихся при выполнении лабораторных опытов, вырабатывать умение наблюдать; развивать умение работать в группах и индивидуально.
- Воспитательная: воспитывать способность к сотрудничеству, взаимопомощи, групповой, творческой деятельности, прививать интерес и любовь к химии.
Игра проводится для учащихся 8-х классов, класс заранее делится на 4 команды, каждая команда готовит название, девиз и домашнее задание. Цель домашнего задания: составить кроссворд на формате А3 по 10 вопросов (1 команде на тему «Атомы химических элементов»; 2 команде на тему «Простые вещества»; 3 команде на тему «Соединения химических элементов»; 4 команде на тему «Изменения, происходящие с веществами»).
Оценивают работу команд и определяют победителя члены жюри – учащиеся старших классов. Игру проводит ведущий.
Оборудование для мероприятия: мультимедийный проектор, воздушные шарики, карточки с заданиями, химическая посуда для конкурса, реактивы и лабораторное оборудование для занимательных опытов.
Ход мероприятия
I. Организационный момент
Приветствие команд, жюри, зрителей. Ознакомление с общими правилами игры. Сбор домашнего задания с каждой команды (кроссворды нумеруются для последнего конкурса).
Девиз мероприятия: «Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции» (М.В. Ломоносов).
II. Проведение конкурсов
Конкурс «В стране химических загадок»
Ведущий загадывает загадки, а команды по очереди отвечают. Если команда не знает ответа, ход передаётся следующей команде. За правильный ответ даётся по 1 баллу.
- Газ – ненужный нам отброс –
В поле в пищу перерос. (Углекислый газ). - Он безжизненным зовется,
Но жизнь без него не создается. (Азот). - По прозванью инвалид,
Но крепок в деле и на вид. (Хром). - Получишь газы из воды,
Смешаешь вместе – жди беды. (Гремучая смесь из водорода и кислорода).
(Гремучая смесь из водорода и кислорода). - В воду шел и чист и бел,
Окунулся – посинел. (Сульфат меди (II)). - Порознь каждый ядовит,
Вместе – будит аппетит. (Хлорид натрия). - Расставьте их так, чтоб стали словами:
Первое слово – фигура одна,
Всего в ней, заметьте, четыре угла.
Слово второе сумейте собрать –
Красно-бурую жидкость
Вам надо назвать. (Бром). - Хранят обычно в керосине,
И бегает он по воде,
В природе, помните отныне,
Свободным нет его нигде.
В солях открыть везде возможно,
Желтеет пламя от него,
И получить из соли можно,
Как Деви получил его. (Натрий).
Конкурс «Угадай-ка»
Командам раздаются карточки с заданиями, где необходимо на основе расчётов определить химический элемент. За каждый правильный ответ – 1 балл. На задания отводится 5-7 минут.
На задания отводится 5-7 минут.
1
|
2 |
Определите химический элемент: 1. атомная масса = 32 число нейтронов = 16. 2. число протонов = 17. 3.высшая степень окисления = +4 атомная масса =119 4. элемент 3 периода II А группы. 5. элемент IV B группы, атомная масса = 91. 6. число электронов на последнем уровне = 5, число протонов=15. 7. атомная масса = 79 число нейтронов = 45 8. число электронов = 24. |
3
|
4 |
|
5
|
6 |
|
7
|
8 |
Ответы: 1) S 2) Cl 3) Sn 4) Mg 5) Zr 6) P 7) Se 8) Cr.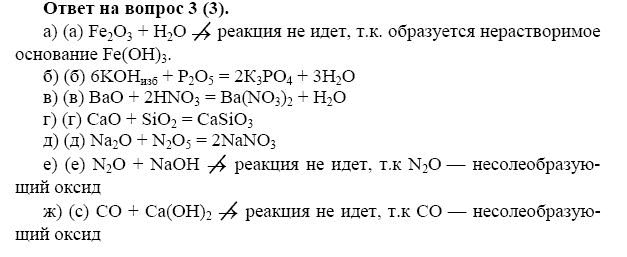
Конкурс «Химическая викторина»
На проекторе воспроизводятся по очереди вопросы для викторины, на обдумывание одного вопроса командам даётся 2-3 минуты, по истечении времени, принимаются ответы команд, за правильный ответ даётся 2 балла.
Вопросы для викторины:
- В фамилии какого ученого девять букв, из них четыре «о»? Какова роль этого ученого в науке? (М.В. Ломоносов. Он ввёл понятие о молекулах и атомах, ввёл взвешивание, разработал способ изготовления цветного стекла, внес вклад в развитие физики, геологии, географии, астрономии и др).
- Какой химический элемент и какому химику помог открыть кот? (В 1811 году французским химиком Куртуа был получен свободный йод. Произошло это так. У Куртуа были приготовлены в двух разных бутылках смеси веществ. В одной – серная кислота с железом, в другой – зола морских водорослей со спиртом. На плече у ученого во время опыта сидел кот. Вдруг кот прыгнул и опрокинул содержимое бутылок.
 Жидкости смешались и от них стали подниматься клубы фиолетового пара, образующие при оседании кристаллы с металлическим блеском и едким запахом. Это был йод).
Жидкости смешались и от них стали подниматься клубы фиолетового пара, образующие при оседании кристаллы с металлическим блеском и едким запахом. Это был йод). - Названия, каких химических элементов связаны с географией их открытия? (Скандий – Скандинавский полуостров; медь – остров Кипр; галлий – Галлия; рутений – Россия; гафний – Копенгаген; тулий – Скандинавия; лютеций – Париж; полоний – Польша; франций – Франция; америций – Америка; калифорний – Калифорния).
- В состав, какого металла входит дерево? (Никель).
- Какой благородный металл состоит из болотных водорослей? (Платина).
- Какой химический элемент вращается вокруг Солнца? (Уран).
Конкурс «Кто быстрее?»
Для этого конкурса заранее приготовлен стол с различной химической посудой. Командам выдаются карточки с названиями химической посуды, их задача с общего стола принести ту посуду, которая указана в их карточках. За правильно принесенную посуду – 1 балл.
Вам необходимо принести: воронку, мерный цилиндр, колбу круглодонную, фарфоровую чашку, пестик. |
Вам необходимо принести: штатив для пробирок, мерный цилиндр, колбу плоскодонную, фарфоровый тигель, ступку. |
Вам необходимо принести: химический стакан, мерный цилиндр, колбу коническую, фарфоровую чашку, пестик. |
Вам необходимо принести: мерный цилиндр, ступку, колбу коническую, фарфоровый тигель, химический стакан. |
Конкурс «Вещества потерялись»
На слайде показаны формулы веществ, командам выдаются таблицы, на которые они переносят эти вещества согласно их классификации. За правильное распределение веществ -1 балл. На конкурс отводится 5-7 минут.
Вещества: CaSO4, HCl, N2O, Cr2O3, NaNO3, KOH, H2SiO3, Cu(OH)2, Cl2O7, HNO3, NaOH, CO2, H3PO4, Cu(NO3)2, CaCl2, Al2O3, Zn3(PO4)2, Al2S3, Na2O, Ni(OH)3, HI.
Соли |
Основания |
Кислоты |
Оксиды |
|
|
|
|
Конкурс «Кто больше?»
На доске закреплены карточки с различными знаками. Командам, необходимо используя эти знаки, составить как можно больше химических формул и дать названия полученным веществам (формулы не должны повторяться). За правильную формулу вещества и название –2 балла. На выполнение задания 5–7 минут.
Варианты карточек:
K |
SO3 |
Zn |
OH |
Cl |
Mg |
H |
Ca |
S |
CO3 |
I |
PO4 |
Конкурс химиков
Для этого конкурса заранее готовятся лабораторное оборудование и реактивы для каждой команды отдельно. От команды выбирается 1 человек, который будет выполнять данный опыт. Ученику выдается лабораторная карточка. Но на столе помимо указанных реактивов еще будут стоять «левые» реактивы, и все реактивы будут подписаны формулами, а не словами, для того чтобы проверить уровень знаний ученика. Необходимо быстро и качественно проделать опыт. Если опыт сделан правильно – 5 баллов.
От команды выбирается 1 человек, который будет выполнять данный опыт. Ученику выдается лабораторная карточка. Но на столе помимо указанных реактивов еще будут стоять «левые» реактивы, и все реактивы будут подписаны формулами, а не словами, для того чтобы проверить уровень знаний ученика. Необходимо быстро и качественно проделать опыт. Если опыт сделан правильно – 5 баллов.
Вариант опыта: В пробирку налить 3-4 мл насыщенного раствора перманганата калия и 1 мл гидроксида калия. К полученной смеси прилить 10-15 капель раствора сульфита натрия. Перемешивать данную смесь.
Если ученик сделал все правильно, то визуально при взбалтывании раствор окрасится в тёмно-зелёный цвет, при дальнейшем перемешивании цвет раствора становится синим, затем – фиолетовым, а потом — малиновым.
Конкурс «Индикаторный мини-квест»
Мини-квест состоит из 3 этапов. Ведущий объясняет каждый этап. Командам необходимо внимательно, правильно и быстро пройти эти этапы. За каждый правильный ответ в кроссворде – 1 балл.
За каждый правильный ответ в кроссворде – 1 балл.
1 этап: командам выдаются штативы с пробирками, индикаторы и реактивы. Команды смешивают реактивы и по цвету раствора переходят во второй этап.
Например:
- 1 команда: лакмус + гидроксид натрия= синий цвет;
- 2 команда: метиловый оранжевый+серная кислота = малиновый цвет;
- 3 команда: фенолфталеин+гидроксид натрия = малиновый цвет;
- 4 команда: лакмус+хлорид натрия = фиолетовый цвет;
2 этап: на доске приготовлены шарики с данными цветами, в шариках находится номер опыта. Команда, проделав опыт с 1 этапа, должна подбежать к своему шарику, лопнуть его и посмотреть номера опыта. Опыты заранее приготовлены для каждой команды и пронумерованы.
Примеры опытов:
- 1 команда: к раствору карбоната натрия прилить соляную кислоту (происходит выделение газа);
- 2 команда: к раствору хлорида бария прилить серную кислоту (выпадает белый осадок);
- 3 команда: к раствору хлорида железа (III) прилить гидроксид натрия (выпадает бурый осадок);
- 4 команда: к раствору сульфата меди прилить гидроксид натрия (выпадает голубой осадок);
3 этап: для данного этапа на стене закреплены листочки с данными цветами и изображением газа. Команда, проделав опыт второго этапа, подбегают к своему листочку, отрывают его от стены и смотрят тему своего кроссворда, которые приготовили ученики дома.
Команда, проделав опыт второго этапа, подбегают к своему листочку, отрывают его от стены и смотрят тему своего кроссворда, которые приготовили ученики дома.
III. Подведение итогов и награждение
Химия: уроки, тесты, задания.
Химия: уроки, тесты, задания.-
-
Предмет химии
-
Физические тела и вещества
-
Чистые вещества и их смеси
-
Разделение смесей.
 Методы очистки веществ
Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
Отличия простых и сложных веществ
-
Валентность.
 Степень окисления. Составление формул по валентностям и степеням окисления
Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ в химических реакциях
-
Уравнения химических реакций
-
-
-
Классификация веществ
-
Металлы
-
Неметаллы
-
Оксиды: классификация, свойства, получение
-
Основания: классификация, свойства, получение
-
Кислоты: состав, свойства, получение
-
Амфотерные гидроксиды
-
Соли: состав и свойства
-
Взаимосвязь между классами неорганических веществ
-
-
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
-
-
-
Электроотрицательность
-
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
-
-
-
Степени окисления элементов
-
Окислители и восстановители, окисление и восстановление
-
-
-
Состав растворов
-
Растворение.
 Растворимость
Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов.
 Индикаторы
Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
-
-
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции.
 Катализаторы
Катализаторы
-
-
-
Свойства водорода
-
Свойства кислорода
-
Вода
-
Галогены.
 Хлор и его соединения
Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор. Соединения фосфора
-
Углерод.
 Соединения углерода
Соединения углерода
-
Кремний. Соединения кремния
-
-
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
-
-
-
Состав и строение органических веществ
-
Углеводороды.
 Полимеры
Полимеры
-
Одноатомные и многоатомные спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы: классификация и свойства
-
Белки
-
-
-
Природные источники углеводородов
-
Химия и пища.
 Химия и здоровье
Химия и здоровье
-
-
-
Методы научного познания. Химический эксперимент
-
Методы получения, собирания и распознавания газов
-
Обнаружение ионов
-
-
-
Физические величины
-
Относительная атомная и молекулярная массы.
 Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
-
-
-
Предмет органической химии.
 Теория химического строения органических веществ А. М. Бутлерова
Теория химического строения органических веществ А. М. Бутлерова
-
Состояние электронов в атоме; s-, p- орбитали. Электронная конфигурация атома
-
-
Где остальные темы
Тестовые задания по химии за курс 8 класса | Тест по химии (8 класс):
Вариант I
1. Символ химического элемента магния
Символ химического элемента магния
1) Мn 3) Mg
2) Mo 4) Md
2. Физическим природным явлением следует считать
1) образование глюкозы в зеленом растении
2) лесной пожар
3) высыхание дождевых луж
4) процесс дыхания растений
3 Индивидуальным веществом является
1) морская вода 3) поваренная соль
2) сладкий чай 4) воздух
4. О химическом элементе, а не простом веществе азот идет речь в выражении
1) азот является составной частью воздуха
2) взрывчатое вещество тротил содержит азот
3) формула азота N2
4) жидкий азот иногда используется для замораживания продуктов
5. Электронная формула внешнего энергетического уровня 2s22p2соответствует атому
1) лития 3) азота
2) углерода 4) кислорода
6. Наиболее ярко выраженные металлические свойства сред элементов 2-го периода периодической системы химических элементов Д.И.Менделеева проявляет
Наиболее ярко выраженные металлические свойства сред элементов 2-го периода периодической системы химических элементов Д.И.Менделеева проявляет
1) бор 3) натрий
2) бериллий 4) литий
7. Высшую и низшую валентность сера проявляет в соединениях соответственно
1) SO3 u ZnS 3) SO3 u SO2
2) SO2 u H2S 4) H2S u SO3
8. Сумма коэффициентов в уравнении реакции, схема которой
СО + О2 = СО2
равна
- 3 3) 5
- 4 4) 6
9. Формула кислотного оксида, основания, соли соответственно
1) CrO3, Cu(OH)2, FeCl2 3) CuO, Fe(OH)2, Na2CO3
2) SO2, BaO, H2S 4) H2O, CuO, NaOH
10. Взаимодействие серной кислоты с оксидом меди(II) относится к реакции
Взаимодействие серной кислоты с оксидом меди(II) относится к реакции
1) разложения 3) замещения
2) соединения 4) обмена
11. В уравнении реакции полного сгорания бутана С4Н10, схема которой
1) 4 3) 13
2) 5 4) 15
12. При взаимодействии 1 моль азота и 1 моль кислорода поглотилось 180 кДж теплоты. Термохимическое уравнение этой реакции
1) N + O = NO + 180 кДж
2) N + O = NO – 180 кДж
3) N2 + O2 = 2NO + 180 кДж
4) N2 + O2 = 2NO — 180 кДж
13. Кислород взаимодействует с
1) водой 3) фосфором
2) платиной 4) оксидом магния
14. Водород соединяется с кислородом при
Водород соединяется с кислородом при
1) поджигании смеси этих газов 3) растворении этих газов в воде
2) комнатной температуре 4) повышении давлении
15. Вода не реагирует с
1) натрием 3) кальцием
2) золотом 4) оксидом кальция
16. С соляной кислотой реагируют все вещества группы:
1) СаО, NaOH, Cu(OH)2, NaCl
2) СаО, NaOH, Cu(OH)2, Na2CО3
3) СО2, NaOH, Cu(OH)2, NaCl
4) СО2, NaOH, Cu(OH)2, Na2CО3
17. Гидроксид меди (II) реагирует с:
1) водой 3) оксидом алюминия
2) азотной кислотой 4) золотом
18. Элементом Э в схеме превращений веществ Э → Э2О5 → Н3ЭО4 может быть
Элементом Э в схеме превращений веществ Э → Э2О5 → Н3ЭО4 может быть
1) калий 3) хлор (VII)
2) фосфор (V) 4) углерод (IV)
19. Основным сырьем для получения кислорода в промышленности служит
1) вода 3) горные породы
2) воздух 4) зеленые растения
20. Метилоранжем можно распознать
1)соляную кислоту 3) воду
2) гидроксид железа (III) 4) оксид кремния (IV)
21. Химические свойства воды не используются при получении
1) щелочей из основных оксидов
2) кислот из кислотных оксидов
3) металлов из их оксидов
4) водорода и кислорода электролизом водных растворов
22.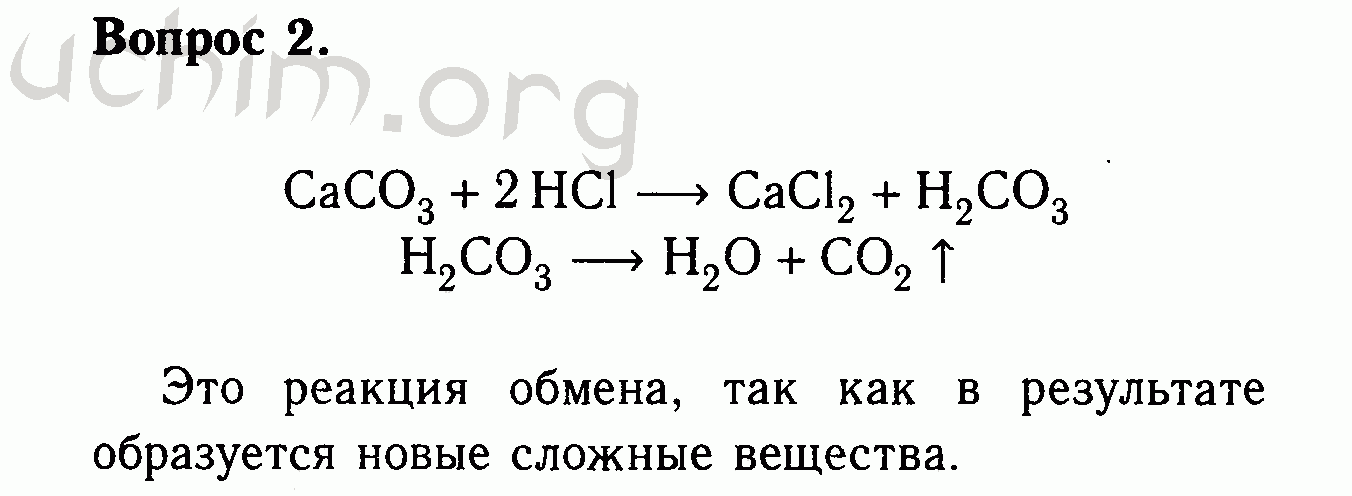 Массовая доля (%) натрия в оксиде натрия Na2O равна приблизительно
Массовая доля (%) натрия в оксиде натрия Na2O равна приблизительно
1) 37 3) 63
2) 59 4) 74
23. Масса цинка, расходуемого для получения 6 моль водорода, при взаимодействии с соляной кислотой
Zn + 2HCl = ZnCl2 + H2↑
составляет
1) 65 г 3) 390 г
2) 130 г 4) 260 г
24. Для приготовления 5%-ного раствора необходимо 2 г сахара растворить в воде массой
1) 19 г 3) 20 г
2) 38 г 4) 40 г
1. |
2. Как называется центр атома? |
3. Верно или нет? Кислоты имеют уровень pH ниже 7. |
4. Какой основной газ содержится в воздухе, которым мы дышим? |
5.Правда или ложь? Электрон несет положительный заряд. |
6. Известный новозеландский ученый Эрнест Резерфорд был удостоен Нобелевской премии в какой области? |
7. Какой химический символ обозначает золото? |
8. К — химический символ какого элемента? |
9. Что вращается вокруг ядра атома? |
10.Какой единственный металл находится в жидкой форме при комнатной температуре? |
11. |
12. Ядерная реакция, при которой ядро атома распадается на более мелкие части, известна как ядерное деление или ядерный синтез? |
13. Что такое H 2 0 более широко известно? |
14.Какой газ находится на третьем месте в воздухе, которым мы дышим? |
15. Как называются вещества, которые изначально участвуют в химической реакции? |
16. Верно или нет? Основания имеют уровень pH ниже 7. |
17. Является ли гидроксид натрия (NaOH) кислотой или основанием? |
18. Атомы одного и того же химического элемента, имеющие разную атомную массу, известны как? |
19. |
20. Какой элемент во Вселенной занимает четвертое место по массе? |
(PDF) Повышение навыков критического мышления учащихся-химиков 8-го класса с помощью метода изучения вопросов и размышлений
218
Центр вдохновенного обучения, философии и педагогического подхода, веб-ресурс, доступен по телефону
http: // www .inspiredteaching.org/inspired-teaching-demonstration-school/philosophy, по состоянию на
9 июня 2017 г.
Чангвонг, К., Суккамарт, А., и Сисан, Б. (2018). Развитие навыков критического мышления: анализ новой модели управления обучением
для тайских средних школ. Журнал международных исследований, 11 (2), 37-48.
Кроуэлл, А. (2011). Оценка трехлетней учебной программы по развитию навыков аргументации (докторская диссертация
).Высшая школа искусств и наук Колумбийского университета, Колумбия.
Duran, M., Dökme, I. (2016). Влияние подхода к обучению, основанного на запросах, на навыки критического мышления учащихся.
. Евразийский журнал математики, науки и технологий образования, 12 (12), 2887-2908
Душл Р., Элленбоган К. и Эрдуран С. (1999). Содействие аргументации в естественных науках в средней школе
классных комнат: оценка проекта SEPIA. Документ, представленный на Ежегодном собрании Национальной ассоциации исследований в области преподавания естественных наук
, Бостон.
Эчеваррия, М. (2003). Аномалии как катализатор накопления знаний учащимися средних школ и научного обоснования
во время научных исследований. Журнал педагогической психологии, 95, 357-374.
Феннимор, Т.Ф., и Тинцманн, М.Б. (1990). Северо-Центральная региональная лаборатория образования. NCREL, Дуб
Ручей.
Фишер Р. (2005). Учим детей думать. Челтнем: Стэнли Торнс.
Фишер Р., Артур Дж., Грейнджер Т и Рэй Д. (2006). Обучение мышлению и творчеству. Учится преподавать в начальной школе
Учится преподавать в начальной школе
, Рутледж Фалмер. http://www.routledge.com/books/Learning-to-Teach-in-the-
Primary-School- isbn9780415359283.
Каплан А. (2017). Оценка исследований по подходу критического мышления посредством контент-анализа.
Международный журнал новых тенденций в искусстве, спорте и научном образовании, 6 (1), 9-17.
Каракоч, М.(2016). Значение способности критического мышления с точки зрения образования. Международный журнал
гуманитарных и социальных наук, 6 (7), 81-84.
Китот А.К.А., Ахмад А.Р. и Семан А.А. (2010). Эффективность обучения исследованиям в повышении критического мышления
студентов. Процедурные социальные и поведенческие науки, 7, 264-273.
Кун Д. (1991). Навыки аргументации. Кембридж, Англия: Издательство Кембриджского университета.
Кун, Д., Го, В., Лорнаду, К., и Шэнфилд, Д. (2008). Спор на компьютере: микрогенетическое исследование
, развивающее навыки аргументации в компьютерной среде. Развитие ребенка, 79 (5), 1311-
Развитие ребенка, 79 (5), 1311-
1329.
Ливингстон, Дж. (1997). Метапознание: обзор. Получено:
http://www.gse.buffalo.edu/fas/shuell/cep564/Metacog.htm.
Магно, К. (2010). Роль метакогнитивных навыков в развитии критического мышления. Познание мяса и обучение
, 5 (2), 137-156.
Мец, К. Э. (2004). Понимание детьми научного исследования: их концептуализация неопределенности в
исследованиях собственного дизайна. Познание и обучение, 22, 219-290.
Нуссбаун, Э. и Синатра, Г. (2003). Аргумент и концептуальное взаимодействие. Современное образование
Психология, 28, 384-395.
Оксфорд, М., Чейтер, Н., и Хан, Ю. (2008). Человеческое мышление и аргументация: вероятностный подход.
В Дж. Адлер и Л. Рипс (ред.), «Рассуждение: исследования человеческого вывода и его основ» (стр. 383-413).
Нью-Йорк, Нью-Йорк: Издательство Кембриджского университета.
Орит Бен-Зеви, А., и Орион, Н. (2005). Развитие навыков системного мышления в контексте системы Земля
образование. Журнал исследований в области преподавания естественных наук, 42 (5), 518-560.
Журнал исследований в области преподавания естественных наук, 42 (5), 518-560.
О’Рурк, М. (2005). Справочник по критическому мышлению пользовательского интерфейса. Университет Айдахо.
Падилья, М.Дж. (1990), Навыки научного процесса. Национальная ассоциация исследований в области преподавания естественных наук Публикация:
«Вопросы исследования — учителю естественных наук» (9004). Получено с веб-сайта National Association of Research in
Science Teaching: http://www.narst.org/publications/research/skill.cfm
Perry, E. (2016). Каждый ребенок ученый: студенческий подход к активному обучению в науке. В:
Международная конференция по обучению и преподаванию: расширение прав и возможностей учащихся 21 века посредством
Целостное и предприимчивое обучение, Куала-Лумпур, Малайзия, 17-18 октября 2016 г.Шеффилд Халлам
University.
Шнайдер В. (2001). Метакогнитивное развитие: образовательные последствия. Международная энциклопедия
социальных и поведенческих наук. (стр. 9730-9733). Центр перспективных исследований в области поведенческих наук
(стр. 9730-9733). Центр перспективных исследований в области поведенческих наук
наук, Стэнфорд, Калифорния, США
Смоллхорн, М., Янг, Дж., Хантер, Н., и Бурке да Силва, К. (2015). Обучение на основе запросов для повышения вовлеченности учащихся
в большую тему первого года обучения.Успех студентов, 6 (2), 65-71
Тебабал А. и Кахссай Г. (2011). Эффекты студентоцентрированного подхода в улучшении навыков графической интерпретации
студентов и концептуального понимания кинематического движения. Лат. Являюсь. J.
Phys. Educ., 5 (2), 374-381
Решения NCERT для науки класса 8 (обновлены для экзаменов 2020-21 гг.)
Решения NCERT для науки класса 8 : Ниже приведены решения NCERT, чтобы помочь студентам ответить вопросы правильно, используя логический подход и методологию.Решения предоставляют обширный материал, позволяющий студентам сформировать хорошую базу и улучшить основы предмета. Вы также можете попрактиковаться в дополнительных вопросах для класса 8 по естествознанию на LearnCBSE. in
in
На этой странице представлены все ссылки на решения NCERT для науки класса 8. Вы можете скачать и скопировать каждую главу «Решения» на свой рабочий стол. Science NCERT, класс 8 Решения — это полезный ресурс, разработанный нашими экспертами по науке для помощи учащимся на экзамене 8 класса.
Решения NCERT для науки 8 класса
По ссылкам ниже представлены подробные решения для учебника NCERT для научного класса 8 .
Решения NCERT для науки 8 класса
РешенияNCERT для науки 8 класса (Загрузить PDF)
Учебники NCERT рекомендованы CBSE как лучшие учебники для подготовки к школе, а также для сдачи экзаменов. Учебников более чем достаточно, без какой-либо помощи других курсов повышения квалификации. Решения разработаны с учетом ясного языка и простоты объяснений, которые даются в учебниках NCERT. Не только школьные экзамены и школьные экзамены, но и учебники NCERT, как известно, играют очень важную роль в JEE и NEET.
NCERT научная книга класса 8 действует как ступенька для дальнейшего обучения в более высоких классах, где вы можете почувствовать, что тема выходит за рамки вашей лиги и трудна для понимания. Концепции учебной программы по естествознанию составляют костяк высших классов. Научные решения NCERT класса 8 помогают прояснить наши основные концепции и сделать их очень простыми и интересными для студентов.
Мы подготовили Класс 8 по науке NCERT Solutions в соответствии с измененной структурой оценки CBSE. Мы подробно обсудили, как выращиваются различные продовольственные культуры.Какие живые организмы мы видим под микроскопом в капле воды? Часть нашей одежды синтетическая? Как сохранить биоразнообразие? Каково внутреннее строение растения? и многое другое.
РешенияNCERT помогут в следующем:
- Аутентичное домашнее задание
- База для подготовки конкурсных экзаменов типа JEE и NEET
- Укрепление основных понятий по предметам
- Безошибочные решения
- Дополнительные задачи для построения базовых концепций
Наука класса 8 Глава 1 Производство сельскохозяйственных культур и управление ими
В этой главе объясняются сельские практики, связанные с созданием урожая и управлением ими. Он включает в себя презентацию различных урожаев, их климатических и питательных потребностей, а также подготовку почвы для всестороннего улучшения урожая
Он включает в себя презентацию различных урожаев, их климатических и питательных потребностей, а также подготовку почвы для всестороннего улучшения урожая
Наука класса 8 Глава 2 Микроорганизмы: друзья и враги
В этой главе рассматриваются разрушительные и ценные виды микробов и их значение в различных областях. Места, где обитают микроорганизмы, микроорганизмы и мы, вредные микроорганизмы, сохранение пищевых продуктов, азотфиксация и азотный цикл — вот лишь часть основных тем, рассматриваемых в этой главе.
Класс 8 Наука Глава 3 Синтетические волокна и пластмасса
В этой главе рассказывается об искусственной текстуре и пластике, которые используются для различных целей. Вид синтетических волокон, характеристики синтетических волокон, пластмассы, пластмассы как предпочтительных материалов, а также пластмасса и окружающая среда являются частью основных положений этой главы.
Наука 8 класса Глава 4 Материалы: металлы и неметаллы
В этой главе описывается мир металлов, неметаллов, их свойства и применение. Этот раздел поможет студентам классифицировать компоненты на металлы и неметаллы на основе их свойств. Физические свойства металлов и неметаллов, химические свойства металлов и неметаллов, использование металлов и неметаллов — вот лишь часть жизненно важных тем, обсуждаемых в этой главе.
Этот раздел поможет студентам классифицировать компоненты на металлы и неметаллы на основе их свойств. Физические свойства металлов и неметаллов, химические свойства металлов и неметаллов, использование металлов и неметаллов — вот лишь часть жизненно важных тем, обсуждаемых в этой главе.
Наука 8 класса Глава 5 Уголь и нефть
Уголь и нефть являются двумя наиболее важными видами топлива, когда-либо найденными человечеством. В главе дополнительно объясняется природный газ и то, как характеристики активов истощаются из-за огромного и неконтролируемого использования.
Наука класса 8 Глава 6 Горение и пламя
В этой главе вы узнаете о различных видах топлива, которые используются для разных целей дома, в промышленности и для запуска автомобилей. Студентам известны такие энергии, как коровий навоз, древесина, уголь, древесный уголь, нефть, дизельное топливо, сжатый газообразный бензин (КПГ) и т. Д. При горении и пламени подробно рассматривается химический процесс горения и виды пламени, возникающие при этом.
Наука 8 класса Глава 7 Сохранение растений и животных
Сохранение растений и животных — важнейший предмет науки.Эта часть подтолкнет учащихся не только к пониманию того, что человек делает упражнения, которые негативно влияют на изобилие природы, но и к тому, как они могут обеспечить сохранение фауны и флоры экосистемы.
Наука класса 8 Глава 8 Ячейка: структура и функции
Объясняет внутреннюю и внешнюю информацию об основной единице lifecell. Он знакомит студентов с открытием клетки, ее наклоном, свойствами и составом
Наука класса 8 Глава 9 Воспроизводство животных
Объясняет способы и процедуру воспроизводства у существ.Это фундаментально для продолжения вида. В этой главе вы выясните, как происходит размножение у животных, о чем подробно рассказывается.
Наука 8 класса Глава 10 Достижение подросткового возраста
В этой главе учащийся узнает об изменениях, происходящих в человеческом теле, после которых человек становится пригодным для воспроизводства. В этой главе мы узнаем о человеческих зачатых органах и роли гормонов в развитии человека .
В этой главе мы узнаем о человеческих зачатых органах и роли гормонов в развитии человека .
Наука класса 8 Глава 11 Формула и давление
Эта глава проведет студентов через великолепный мир силы и давления. Это подтолкнет их к тому, чтобы отстаивать точку зрения, а также усвоить идеи, которые помогут им добиться лучших результатов.
Класс 8 Наука Глава 12 Трение
Это важный раздел физики, который управляет откатом или противодействием движению. Его причины, воздействия, приложения и другие ключевые свойства рассматриваются в его главе.
Наука класса 8 Глава 13 Звук
Звук рассказывает о различии между музыкой и шумом. Шумовое загрязнение, его причины, последствия и меры контроля объясняются в конце главы. Эта глава укрепит вашу базу для будущих сложных тем.
Наука класса 8 Глава 14 Химические эффекты электрического тока
В этой главе мы обнаружим, что металлы, например, медь и алюминий, проводят электричество, в то время как материалы, например, резина, пластик и дерево, не проводят электричество.
Наука класса 8 Глава 15 Некоторые природные явления
Эта глава проливает свет на удивительные явления природы, например, молнию и землетрясение. В этой главе обсуждаются причины, удары, сила и свойства молнии.
Наука 8 класса Глава 16 Свет
Light рассказывает об основных свойствах, воздействии и использовании света и его подчиненных. В этой главе также содержится информация о регулярном отражении, рассеянном отражении, законах отражения и т. Д.
Наука класса 8 Глава 17 Звезды и Солнечная система
В этой главе рассказывается о небесных объектах. В этой главе показано положение этих объектов, их структура и центральность. В этой части также обсуждается Луна, периоды Луны, ее положение в планетной системе и поверхность Луны.
Наука класса 8 Глава 18 Загрязнение воздуха и воды
В этой главе рассматривается решение проблемы небезопасного чуда загрязнения и то, как можно добавить к его уменьшению в отдельном измерении. Загрязнение воздуха, как он загрязняется — вот некоторые из важных тем, обсуждаемых в этой главе.
Загрязнение воздуха, как он загрязняется — вот некоторые из важных тем, обсуждаемых в этой главе.
Решения гарантированно безошибочны и легко понятны. Студентам рекомендуется сослаться на эти аутентичные решения по нескольким учебникам для повышения квалификации. Учебники NCERT предписаны CBSE и, следовательно, являются наиболее достоверным источником знаний в школьной программе.
Часто задаваемые вопросы о решениях NCERT для науки 8 класса
1. Какой лучший справочник или путеводитель по науке 8 класса?
Кандидатымогут использовать NCERT Solutions for Class 8 Science, чтобы улучшить свою подготовку к экзамену.Во время подготовки вы можете использовать учебники NCERT, рекомендованные экспертами.
2. Что является ключом к получению большего количества баллов на научном экзамене CBSE Class 8?
Единственный способ набрать больше баллов на экзамене 8 класса — это строгая практика. Следуйте правильному расписанию и с легкостью сдайте экзамен.
3. Где я могу получить решения для книг NCERT?
Вы можете получить решения NCERT по главам на нашей странице и использовать их для получения хороших результатов.Легко узнавайте темы, которые вы хотите подготовить, поскольку они отсортированы по родительским темам.
4. Какие концепции объясняются в решениях NCERT Class 8 Science Textbook?
Преобладающие научные решенияNCERT Class 8 предоставят вам темы в конце каждой главы. Все 18 глав подробно описаны. Взгляните на научные решения NCERT Class 8 и список из 18 глав в нем.
5. Почему решения NCERT для науки класса 8 важны?
РешенияNCERT разработаны таким образом, чтобы учащиеся могли быстро усвоить концепции и решить все ваши вопросы.Книги говорят сами за себя, и с их помощью вы можете оценить свои способности к обучению.
6. Сколько стоят научные решения NCERT класса 8?
Вы можете бесплатно получить доступ к научным решениям NCERT Class 8 с нашей веб-страницы. Получите глубокие знания о научных концепциях, обратившись к учебникам NCERT.
Получите глубокие знания о научных концепциях, обратившись к учебникам NCERT.
Дополнительные материалы для изучения 8 класса CBSE
Вопросы MCQ для науки класса 8 Глава 14 Химические эффекты электрического тока с ответами
Проверьте приведенные ниже вопросы NCERT MCQ для науки класса 8 Глава 14 Химические эффекты электрического тока с ответами Pdf бесплатно.Вопросы MCQ для класса 8 по естествознанию с ответами были подготовлены на основе последней схемы экзамена. Мы предоставили вопросы MCQ по науке о химическом воздействии электрического тока 8 класса с ответами, чтобы помочь студентам очень хорошо понять эту концепцию.
Вы можете обратиться к NCERT Solutions for Class 8 Science, глава 14 «Химические эффекты электрического тока», чтобы эффективно пересмотреть концепции программы и повысить свои шансы на получение высоких оценок на экзаменах.
Химические эффекты электрического тока MCQ класса 8 Вопросы с ответами
Выберите правильный вариант.
Вопрос 1.
Что из перечисленного является плохим проводником электричества?
(a) Дистиллированная вода
(b) Нитрат серебра
(c) Серная кислота
(d) Сульфат меди
Ответ: (а) Дистиллированная вода
Вопрос 2.
Что из перечисленного не проводит электричество?
(a) Раствор сахара
(b) Раствор уксуса
(c) Раствор лимонного сока
(d) Раствор каустической соды
Ответ: (а) Раствор сахара
Вопрос 3.
Электрический ток может вызывать
(a) эффект нагрева
(b) химический эффект
(c) магнитный эффект
(d) все эти
Ответ: (г) все эти
Вопрос 4.
Чистая или дистиллированная вода — это
(a) плохой проводник
(b) хороший проводник
(c) и (a), и (b)
(d) ни один из этих
Ответ: (а) плохой проводник
Вопрос 5.
Что из перечисленного является хорошим проводником?
(a) Кирпич
(b) Сталь
(c) Пластик
(d) Хлопок
Ответ: (б) Сталь
Вопрос 6.
Полиэтилен
(a) проводник
(b) изолятор
(c) оба (a) и (b)
(d) ни один из этих
Ответ: (б) изолятор
Вопрос 7.
Гальваника основана на
(a) тепловое воздействие электричества
(b) химическое воздействие электричества
(c) физическое воздействие электричества
(d) магнитное воздействие электричества
Ответ: (б) химическое действие электричества
Вопрос 8.
Медь
(а) хороший проводник
(б) изолятор
(в) и (а), и (б)
(г) ни один из этих
Ответ: (а) хороший проводник
Вопрос 9.
Отходы гальванического завода должны быть выброшены из
(a) в соседнюю реку
(b) в соседний пруд
(c) на близлежащем кукурузном поле
(d) в соответствии с инструкциями по утилизации Органов по обращению с отходами
Ответ: (d) в соответствии с инструкциями по удалению отходов
органов по обращению с отходами. Вопрос 10.
Электролит — это
(a) металл
(b) жидкость, которая проводит ток
(c) неметалл
(d) ни один из этих
Ответ: (б) жидкость, проводящая ток
Вопрос 11.
Поток электронов называется
(а) электролит
(б) гальваника
(в) электроды
(г) электрический ток
Ответ: (г) электрический ток
Вопрос 12.
Что не является электролитом?
(a) Этиловый спирт
(b) Хлорид натрия
(c) Мочевина
(d) Раствор натрия
Ответ: (б) Хлорид натрия
Вопрос 13.
Электрическая лампа светится из-за
(а) теплового эффекта
(б) магнитного эффекта
(в) химического воздействия
(г) физического воздействия
Ответ: (а) эффект нагрева
Вопрос 14.
Гальваника предотвращает
(а) коррозию
(б) прохождение тока
(в) диссоциацию
(г) сияние
Ответ: (а) коррозия
Вопрос 15.
Что из следующего не используется для гальваники металлических изделий?
(а) Никель
(б) Серебро
(в) Хром
(г) Натрий
Ответ: (г) Натрий
Вопрос 16.
Железные предметы можно защитить, нанеся на них гальваническое покрытие
(a) хромом
(b) никелем
(c) цинком
(d) всеми этими
Ответ: (г) все эти
Вопрос 17.
В светодиодах более длинный вывод (провод) всегда подключается к _______ клемме
(a) отрицательная
(b) нейтральная
(c) положительная
(d) любая клемма
Ответ: (в) положительно
Вопрос 18.
Водопроводная вода является хорошим проводником электричества, в то время как дистиллированная вода — нет, потому что
(a) Водопроводная вода содержит соли
(b) Дистиллированная вода не содержит соли
(c) Правильно только (a)
( г) Оба пункта (а) и (б) верны
Ответ: (б) Дистиллированная вода не содержит соли
Вопрос 19.
Когда электроды погружаются в воду и пропускается электричество, пузырьки, образующиеся на положительной клемме, на самом деле являются _______ газом.
(a) Водород
(b) Двуокись углерода
(c) Кислород
(d) Азот
Ответ: (c) Кислород
Вопрос 20.
Когда электроды погружаются в воду и пропускается электричество, пузырьки, образующиеся на отрицательной клемме, на самом деле являются _______ газом.
(a) Водород
(b) Двуокись углерода
(c) Кислород
(d) Азот
Ответ: (а) Водород
Вопрос 21.
Почему мы добавляем немного разбавленной серной кислоты в раствор сульфата меди во время гальваники?
(a) Для увеличения кислотности
(b) Для увеличения проводимости
(c) Чтобы цвет стал более заметным
(d) Для сжигания сульфата меди
Ответ: (б) Для увеличения проводимости
Вопрос 22.
На железо нанесено покрытие из _________ для защиты от коррозии и образования ржавчины
(a) медь
(b) алюминий
(c) цинк
(d) серебро
Ответ: (c) Цинк
Вопрос 23.
Хромирование наносится на многие предметы, такие как автомобильные детали, краны для ванн, кухонная газовая плита и т. Д. Почему?
(a) Не корродирует, но предотвращает появление царапин
(b) Красиво выглядит
(c) Стоит дешевле
(d) Товары можно продавать по более высокой цене
Ответ: (а) Не корродирует, но предотвращает появление царапин
Вопрос 24.
Процесс нанесения слоя любого желаемого металла на другой материал с помощью электричества называется ___________.
(a) Гальваническое покрытие
(b) Гальваническое покрытие
(c) Электроосаждение
(d) Ни один из вышеперечисленных
Ответ: (б) Гальваника
Вопрос 25.
Некоторые жидкости являются хорошими проводниками электричества, а некоторые — плохими проводниками. Какой дирижер плохой?
(a) Кислый раствор
(b) Щелочной раствор
(c) Раствор обыкновенной соли
(d) Дистиллированная вода
Ответ: (г) Дистиллированная вода
Вопрос 26.
Жестяные банки, используемые для хранения продуктов, изготавливаются путем нанесения гальванического покрытия оловом на железо. Почему?
(a) Олово дает блестящий вид
(b) Чтобы сделать сосуд дешевым
(c) Олово менее реактивно, чем железо.
(d) Для облегчения сосуда
Ответ: (c) Олово менее реактивно, чем железо.
Сопоставьте элементы, указанные в столбце I, соответствующим образом, с элементами, указанными в столбце II.
| Столбец I | Колонна II |
| 1. Замкнутый путь | (а) Хороший проводник |
| 2. Светодиод | (б) Отклонение компаса |
| 3. Карбоновый стержень | (c) Положительно заряженный ион |
| 4.Гальваника | (г) Плохой проводник электричества |
| 5. Вода дистиллированная | (e) Покрытие цинком |
6. Солевой раствор Солевой раствор | (е) Электроды |
| 7. Катион | (г) Светодиоды |
| 8. Магнитное действие тока | (ч) Электросхема |
| 9. Хром | (i) Отрицательно заряженный ион |
| 10.Анион | (j) Гальваника |
Ответ:
| Столбец I | Колонна II |
| 1. Замкнутый путь | (ч) Электросхема |
| 2. Светодиод | (г) Светодиоды |
| 3. Карбоновый стержень | (е) Электроды |
| 4. Оцинковка | (e) Покрытие цинком |
| 5.Вода дистиллированная | (г) Плохой проводник электричества |
| 6. Солевой раствор | (а) Хороший проводник |
| 7. Катион | (c) Положительно заряженный ион |
8. Магнитное действие тока Магнитное действие тока | (б) Отклонение компаса |
| 9. Хром | (j) Гальваника |
| 10. Анион | (i) Отрицательно заряженный ион |
Заполните пропуски подходящими словами.
1. Вещества, проводящие электричество, называются ___________.
ОтветОтвет: Проводники
2. Вещества, не проводящие электричество, называются ___________.
ОтветОтвет: изолятор
3. Катион имеет ___________ заряд.
ОтветОтвет: положительный
4. Некоторые жидкости являются ___________ проводниками электричества, а некоторые ___________ проводниками электричества.
ОтветОтвет: хорошо, плохо
5.Дистиллированная вода ___________.
ОтветОтвет: изолятор
6. Дистиллированная вода при смешивании с солями становится ___________ проводником электричества.
ОтветОтвет: хорошо
7. Светодиоды (LED) светятся даже тогда, когда через них протекает ___________ электрический ток.
Светодиоды (LED) светятся даже тогда, когда через них протекает ___________ электрический ток.
Ответ: слабый
8. Прохождение электрического тока через проводящий раствор вызывает ___________.
ОтветОтвет: химическая реакция
9.Изменение цвета является примером ___________ эффекта тока.
ОтветОтвет: химический
10. К светодиоду подключено ___________ проводов.
ОтветОтвет: два
11. В светодиодах более длинный вывод подсоединяется к клемме ___________ батареи, а более короткий вывод — к клемме ___________.
ОтветОтвет: положительный, отрицательный
12. Хром имеет вид ___________.
ОтветОтвет: блестящий
13.Дистиллированная вода производится путем удаления всего ___________.
ОтветОтвет: примеси
14. Железо имеет тенденцию к ___________ и ___________.
ОтветОтвет: ржавчина, ржавчина
15. На железо наносится покрытие ___________ для защиты от коррозии и образования ржавчины.
Ответ: цинк
16. Электролампа светится ___________ действием электрического тока.
ОтветОтвет: отопление
17.Электроды ___________.
ОтветОтвет: кондукторы
18. Отклонение в ___________ показывает, что ток проходит.
ОтветОтвет: магнитный компас
19. ___________ не подвержен коррозии.
ОтветОтвет: Хром
20. Электролит ___________.
ОтветОтвет: жидкость
Укажите, верны ли данные утверждения.
1. Каучук — хороший проводник электричества.
ОтветОтвет: Ложь
2. Пластмассы плохо проводят электричество.
ОтветОтвет: Верно
3. Все жидкости проводят электричество.
ОтветОтвет: Ложь
4. Дистиллированная вода не содержит соли.
ОтветОтвет: Верно
5. Чистая вода проводит электричество.
ОтветОтвет: Ложь
6. Большинство жидкостей, проводящих электричество, представляют собой растворы кислот, оснований и солей.
Ответ: Верно
7. Гальваника основана на магнитном воздействии электричества.
ОтветОтвет: Ложь
8. В воде естественным образом присутствует небольшое количество некоторых минеральных солей.
ОтветОтвет: Верно
9. Хром канцерогенен.
ОтветОтвет: Верно
10. Электрическая лампочка светится от химического воздействия электричества.
ОтветОтвет: Ложь
11.Дистиллированная вода при смешивании с солью проводит электричество.
ОтветОтвет: Верно
12. Светодиод — электрическая лампочка, которая используется в тестере.
ОтветОтвет: Верно
13. Отклонение стрелки компаса вызвано магнитным действием тока.
ОтветОтвет: Верно
14. При пропускании электрического тока через раствор сульфата меди происходит диссоциация ионов меди и сульфата.
ОтветОтвет: Верно
15.В светодиодной лампе более короткий провод подключается к положительной клемме аккумулятора.
Ответ: Ложь
16. Электрический ток производит магнитное действие.
ОтветОтвет: Верно
17. Некоторые жидкости являются хорошими проводниками электричества, а некоторые — плохими проводниками.
ОтветОтвет: Верно
18. Хром имеет блестящий вид.
ОтветОтвет: Верно
19. Ювелиры гальванизируют серебро и золото на дорогие металлы.
ОтветОтвет: Ложь
20. Отходы гальваники полезны для здоровья человека и окружающей среды.
ОтветОтвет: Ложь
Мы надеемся, что данная бесплатная загрузка PDF-файла «Вопросы NCERT MCQ для класса 8 по естествознанию, глава 14« Химические эффекты электрического тока »с ответами поможет вам. Если у вас есть какие-либо вопросы относительно химического воздействия электрического тока CBSE Class 8 Science MCQs Multiple Choice Questions with Answers, оставьте комментарий ниже, и мы скоро свяжемся с вами.
Школа химии Дока Брауна Тесты и рабочие листы Викторины перечисленные ниже подходят для химии GCSE, химии IGCSE, уровня O химия, ~ 9 и 10 классы в США, курсы химии или их эквиваленты для учеников в возрасте от ~ 14 до 16 лет летние и любые англоговорящие студенты школы химии Указатель викторин по химии с несколькими вариантами ответов, рабочие листы для заполнения пробелов, кроссворды, Вопросы для повторения практического экзамена — все сгруппированы по различным тематическим областям за ревизию См. Тесты по химии для Спецификации химии GCSE — соответствуют темам модуля химии Указатель ВСЕХ учебных программ GCSE Ссылки на справку Довузовская химия продвинутого уровня [ПОИСК КОРОБКА] Копирование тестов школами, колледжами и т. Д.не разрешено Доктор ВП Коричневый Викторины также обложка Радиоактивность и науки о Земле Для большинства британских студентов, изучающих естественные науки 9-1 GCSE, применяются следующие справочные страницы: используйте и добавьте в закладки левую ссылку под Редакция KS4 Science IGCSE / O level / GCSE Информационные заметки по изучению химии для проверки для AQA GCSE Science, CCEA / CEA наука-ХИМИЯ, Edexcel GCSE Science / IGCSE Chemistry & OCR 21st Century Science, OCR Gateway Science и WJEC наука-ХИМИЯ (пересмотреть курсы, соответствующие 9-10 классам США) Из-за количества и различные доступные упражнения по пересмотру GCSE / IGCSE / KS4 Science-CHEMISTRY, они организованы под следующими 23 заголовками ссылок, которые также необходимо щелкнуть: 1. 2. Скорость химической реакции Факторы 3. Периодическая таблица 4. Группа 1 Щелочные металлы 5. Переходные металлы 6. Более широкие викторины по металлам 7. Группа 0 Благородные газы 8. Группа 7 Галогены 9. Обратимые реакции, Равновесие, Аммиак Производство и использование 10.Использование известняка и химия 11. Масло и полезные продукты и органическая химия 12. Шкала pH, кислоты, основания, соли 13. Добыча металлов из руд 14. В Ряд реакционной способности металлов, ржавления и окислительно-восстановительного потенциала реакция 15. Энергетические изменения в химических реакциях 16. Состояния материи (газ, жидкость и твердое тело) и изменения состояний 17.Атомный структура, изотопы, электронная структура 18. Структура, свойства и связь материалов 19. Химическая промышленность Расчеты 20. 21. Электролиз и его приложения 22. Радиоактивность, радиоизотопы и ядерная энергия 23. Химическая тесты на идентификацию I
надеюсь, что все эти тесты для самооценки и рабочие листы окажутся полезными , какой бы курс вы ни изучали.Прокрутите вниз, чтобы увидеть, что предлагается, а значит F / H
дифференциация для UK GCSE / IGCSE Foundation / викторин более высокого уровня (это в основном
означает легче при ограниченных знаниях и сложнее при решении более широких вопросов). Если
они не работают в вашем браузере, скачайте Mozilla Firefox 1.5, они должны работать
хорошо на этом. ВАЖНО —
Чтобы повторить тест, нажмите (Повторить
Викторина) КНОПКА с использованием обновления страницы
может вызвать проблемы. 10 м / c Q выбираются случайным образом из
база данных 50-250 вопросов. При выполнении теста KS4-GCSE-IGCSE с множественным выбором
расчётные викторины по науке и химии, если
вы получите правильный ответ, при выборе A-D в поле появится ДА. Нажмите кнопку со значком Тест с несколькими вариантами ответов * упражнение на листе wordfill * поиск совпадений пар кроссворд * упражнение с беспорядочными предложениями * ссылки на другие материалы введите короткие ответы викторины 1.Общая химия — основные идеи 2. Скорость химических реакций 3. В основы Периодической таблицы
4. 5. Переходные металлы и их соединения 6. Металлические викторины с более широким диапазоном
7. Группа 0 Благородные газы 8. Группа 7 Галогены (элементы, соединения, свойства и использование) 9. Обратимые реакции, равновесие, аммиак, синтез азотной кислоты & Использует 10. Известняк, его химический состав и области применения 11. В Продукты нефти, органической химии, загрязнения, изменения климата 12.
13. 14. В Реакционная способность металлов, ржавчины и R edox реакции 15. Изменения энергии в химических реакциях 16. Состояния материи (газ, жидкость и твердое тело) и изменения состояний 17. Атомный структура, изотопы и электронное строение атомов 18. Структура, свойства и химическая связь материалов 19. Химическая Расчеты 20. Викторины по наукам о Земле (геология, типы горных пород, эволюция атмосферы, тектоника плит и др.) 21. Электролиз и его приложения 22. (включая альфа-, бета- и гамма-излучение, их свойства и использование, изотопы, деление и т. д.) 23. Качественный Химический анализ для идентификации ионов (катионов и анионов), газы, соединения и др. В разделах KS3 Science-Chemistry есть основные материалы для пересмотра для начала GCSE / IGCSE Тематические курсы Химия GCSE Пересмотр химии IGCSE вопросы по химии для повторных вопросов KS4 GCSE Science по химии для GCSE руководство по химии вопросы по химии для школ колледжи академии естественные науки преподаватели изображений картинки диаграммы для вопросов химии наука химия пересмотр вопросы по химии для пересмотра тем модуля по химии примечания, чтобы помочь в понимании вопросы химии университетские курсы по естествознанию карьера в науке работа в промышленности лаборант стажировки технические стажировки США США 8 класс 9 класс 10 AQA химия вопросы GCSE по химии для Edexcel химические науки вопросы по химии для OCR химия 21 века вопросы по химии для OCR GCSE Gateway science вопросы химии по химии для WJEC gcse science chemistry вопросы по химии для CCEA / CEA gcse Заметки по химии наука О уровень Заметки по химии для химии вопросы IGCSE химия ревизия вопросы по химии для уровня O химия заметки gcse химия ревизия бесплатные подробные заметки по вопросам химии gcse, которые помогут пересмотреть химию gcse Заметки о пересмотре химии igcse по вопросам химии gcse химия уровня O Бесплатные подробные примечания по вопросам химии gcse, чтобы помочь пересмотреть gcse химия бесплатные подробные заметки по вопросам химии gcse, которые помогут пересмотреть уровень O бесплатный онлайн-сайт по химии, чтобы помочь пересмотреть химию gcse вопросы для gcse бесплатный онлайн-сайт по химии, чтобы помочь пересмотреть gcse вопросы по химии для Бесплатный онлайн-сайт igcse Chemistry, который поможет пересмотреть уровень O gcse химия вопросы химии как добиться успеха в вопросах по вопросы по химии gcse для gcse химия как добиться успеха в igcse химия как добиться успеха по химии уровня O хороший сайт для бесплатных вопросов по вопросы gcse по химии, чтобы помочь сдать вопросы gcse по химии gcse химия вопросы хорошие сайт бесплатно помогите пройти igcse химия с доработкой заметки по вопросам химии gcse хороший сайт для бесплатной помощи для прохождения уровня O химия учиться химия в Кембриджском университете учиться химия в Оксфордский университет изучает химию в Даремском университете исследование химия в Йоркском университете изучать химию в Эдинбурге В университете изучают химию в Университет Сент-Эндрюс изучает химию в Имперском колледже Лондона Университет изучает химию в Уорикском университете изучает химию в университете Сассекса изучают химию в университете Бата учатся химии в Ноттингемском университете изучать химию в Университет Суррея изучает химию в Бристольском университете изучать химию в Кардиффском университете изучать химию в Бирмингеме Университет изучает химию в Манчестерском университете учеба химия в Университетском колледже Лондонского университета учеба химия в Университет Стратклайда изучает химию в Лафборо Университет изучает химию в Саутгемптонском университете исследование химия в Университет Шеффилда изучает химию в Университете Глазго изучать химию в Ливерпульском университете изучать химию в Лидсе Университет изучает химию в Куинсе, исследование Белфастского университета химия в Королевском колледже Лондонского университета изучает химию в Хериот-Ватт Университет изучает химию в Ланкастерском университете химия в Восточной Англии (UEA) Университет изучает химию в университете Ньюкасла исследование химия в университете Кил изучать химию в Лестере Университет изучать химию в университете Бангора учеба химия в Университете Ноттингем Трент изучать химию в Кенте Университет изучает химию в Абердинском университете химия в Университете Ковентри изучать химию в Шеффилд Халлам В университете изучают химию в Астонском университете изучают химию в университете Халла изучать химию в университете Брэдфорда учиться химия в Университете Хаддерсфилда изучать химию в Королеве Мэри, Лондонский университет Университет изучает химию в Университете Рединга изучает химию в Glyndwr University изучает химию в Брайтонском университете изучать химию в Манчестерском столичном университете учиться химия в университете Де Монфор изучать химию в Нортумбрии Университет изучает химию в университете Южного Уэльса химия в Ливерпульском университете Джона Мура изучает химию в Центральном Ланкашире Университет изучает химию в Кингстонском университете химия в Западном Шотландском университете изучать химию в Линкольне Университет изучает химию в Плимутском университете химия в Гринвичском университете изучать химию в Ливерпуле Столичный университет |
Наука класса 8 Глава 4 MCQ (вопросы с множественным выбором) 2020-2021
MCQ 8 класса по науке на 2020-21 год
| Класс 8 | Science |
| Содержание: | Вопросы с несколькими вариантами ответов — тесты MCQ |
MCQ 8 класса по науке для экзаменов
Тесты MCQ класса 8 по естествознанию, глава 4, приведены ниже. Тесты разделены на 5 вопросов. После выбора опции вы также можете увидеть правильный ответ и его объяснение. Все вопросы относятся только к учебнику NCERT 8-го класса по естествознанию. Чтобы принять участие в новом тесте, в конце дается кнопка «Начать новый тест».
Тесты разделены на 5 вопросов. После выбора опции вы также можете увидеть правильный ответ и его объяснение. Все вопросы относятся только к учебнику NCERT 8-го класса по естествознанию. Чтобы принять участие в новом тесте, в конце дается кнопка «Начать новый тест».
Q1
Рассмотрите следующие утверждения и выберите правильный:
[A]. Калий является наиболее химически активным металлом, поскольку он находится в верхней части ряда реакционной способности.
[В]. Золото является наименее химически активным металлом, поскольку оно находится в нижней части ряда реакционной способности.
[C]. Реакция взаимодействия неметалла гидроксида натрия и основания, но без образования газообразного водорода.
[D]. Все выше.
Ответ: Вариант D
Пояснение:Все приведенные выше утверждения верны. Следовательно, ваш ответ будет вариантом [D].
Q2
Обычно оксиды металлов являются основными, а оксиды неметаллов имеют кислотную природу.
 Раствор какого из следующих оксидов в воде изменит цвет голубой лакмуса на красный?
Раствор какого из следующих оксидов в воде изменит цвет голубой лакмуса на красный?[А].Диоксид серы
[B]. Оксид железа
[C]. Оксид магния
[D]. Оксид меди
Ответ: Вариант A
Пояснение:Сера является неметаллом и образует кислый оксид, например, диоксид серы (SO2), который окрашивается в синий лакмусовый красный цвет.
Q3
Как получить «гидроксид меди»?
[А]. Когда медь горит на воздухе.
[В]. Когда медь реагирует с водородом и кислородом.
[C]. Когда медь вступает в реакцию с углекислым газом.
[D]. Когда медь вступает в реакцию с водой, углекислым газом и кислородом.
Ответ: Вариант D
Пояснение: Когда медный объект подвергается длительному воздействию влажного воздуха, медь вступает в реакцию с водой, углекислым газом и кислородом, присутствующими во влажном воздухе, с образованием зеленого покрытия на медном объекте. Зеленое покрытие или зеленый материал представляет собой смесь гидроксида меди и карбоната меди, которая образуется при воздействии влажного воздуха на медный объект. Зеленое покрытие меди также известно как основной карбонат меди, потому что он является основным по своей природе.
Зеленое покрытие меди также известно как основной карбонат меди, потому что он является основным по своей природе.
Q4
Внимательно изучите утверждения и выберите, какое из следующих утверждений является или правильным?
[А]. Алмаз — это тот металл, который хорошо проводит тепло.
[В]. Сера и графит — неметаллы, которые хорошо проводят тепло.
[C]. Сера, фосфор и йод — это те неметаллы, которые имеют блеск.
[D]. Ни один из вышеперечисленных.
Ответ: Вариант D
Пояснение:Алмаз — это неметалл, который хорошо проводит тепло.Графит — это неметалл, который является хорошим проводником тепла, а не сера. Йод — это разновидность неметалла, имеющего блеск (не сера и фосфор).
Q5
Рассмотрите следующие утверждения и выберите правильный:
[A]. Алюминий — один из очень ковких металлов.
[В]. Неметалл при ударе молотком разбивается на мелкие кусочки.
[C]. Хрупкость — характерное свойство твердых неметаллов.
[D]. Все выше.
Ответ: Вариант D
Пояснение:Здесь все утверждения верны.Следовательно, ваш ответ будет вариантом [D].
Q6
Буджхо появился в тесте класса, где он написал несколько утверждений, но он смутился, узнав неправильное утверждение. Не могли бы вы помочь ему узнать это?
[А]. Неметаллы имеют низкую плотность, что означает их легкий вес.
[В]. Неметаллы не звучные.
[C]. Неметаллы, ртуть могут находиться в жидком состоянии при комнатной температуре.
[D]. Неметаллы могут быть твердыми, жидкими или газообразными при комнатной температуре.
Ответ: Вариант C
Пояснение:Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре.
Q7
Обдумал вопрос и выбрал лучший ответ: «Неметалл, образующий нейтральный оксид».
[А]. Углерод
[В]. Водород
[C]. Азот
[D]. Сера
Ответ: Вариант B
Пояснение: Большинство неметаллов из кислых оксидов, но есть некоторые исключения. Это связано с тем, что некоторые из неметаллов образуют нейтральные оксиды, которые не являются ни кислотными, ни основными. Например, водород — неметалл, который образует нейтральный оксид h3O, обычно известный как вода.
Это связано с тем, что некоторые из неметаллов образуют нейтральные оксиды, которые не являются ни кислотными, ни основными. Например, водород — неметалл, который образует нейтральный оксид h3O, обычно известный как вода.
Q8
Рассмотрите следующие утверждения и выберите неверный:
[A]. Податливые средства, которые можно разбивать (можно сломать) молотком с образованием тонких листов.
[В]. Под пластичным подразумевается, что его можно растягивать или тянуть для образования тонкой проволоки.
[C].Хрупкость означает, что при ударе или растяжении распадается на куски.
[D]. Блестящий означает блестящий.
Ответ: Вариант A
Пояснение:Свойство, позволяющее забивать металлы в тонкие листы, называется пластичностью. Ковкость — важное характеристическое свойство металлов. Помните, что это податливое средство, которое может быть разбито (но не сломано) молотком с образованием тонких листов.
Q9
Буджхо появился в тесте класса, где он написал несколько утверждений, но он не знал, какое утверждение правильное.
 Не могли бы вы помочь ему узнать это?
Не могли бы вы помочь ему узнать это?[А]. Металлы являются хорошими проводниками электричества, но плохими проводниками тепла.
[В]. Некоторые металлы реагируют с гидроксидом натрия с образованием газообразного водорода.
[C]. Когда металлы реагируют с кислотой, они образуют газообразный кислород.
[D]. Неметаллические оксиды превращают красную лакмусовую бумажку в синюю.
Ответ: Вариант B
Пояснение: Некоторые металлы реагируют с основанием с образованием солей и газообразного водорода. Алюминий — это металл, а гидроксид натрия — это основание.Когда алюминий нагревают с раствором гидроксида натрия, образуются алюминат натрия (соль) и газообразный водород. Металлический цинк также реагирует с раствором гидроксида натрия с образованием газообразного водорода. Хотя алюминий и цинк — два обычных металла, которые реагируют с основанием (например, гидроксидом натрия) с образованием газообразного водорода. В целом можно сказать, что некоторые металлы реагируют с «гидроксидом натрия» с образованием газообразного водорода. Но все металлы не реагируют с основаниями, такими как «гидроксид натрия», с образованием газообразного водорода.
Но все металлы не реагируют с основаниями, такими как «гидроксид натрия», с образованием газообразного водорода.
Q10
Неметалл пурпурного цвета образует коричневый раствор в спирте, который наносится на раны в качестве антисептика. Назовите неметалл.
[А]. Сера
[В]. Натрий
[C]. Йод
[D]. Хлор
Ответ: Вариант C
Пояснение:Йод — это неметалл, который используется для изготовления раствора пурпурного цвета под названием «Tincher Yodine», который наносится на порезы и раны в качестве антисептика.
Что подразумевается под блеском?
Металлы обычно блестят и хорошо полируются.Электронная структура металлов такова, что они способны отражать падающий свет. Этот характерный металлический элемент называется блеском.
Почему металлы называют пластичными?
Способность металлов плавиться и вытягиваться в тонкую проволоку называется пластичностью. Из-за этого свойства металлы известны как пластичные.
Что произошло, когда металл вступил в реакцию с разбавленными кислотами?
Большинство металлов реагируют с разбавленными кислотами (серной и соляной кислотами), замещая водород и образуя соль.Выделяется газообразный водород.
Что такое сплав?
Сплав представляет собой однородную смесь двух или более металлов или металла и одного или нескольких неметаллов
Физические свойства металлов
| Физическое состояние: | Металлы обычно твердые при комнатной температуре. Единственное исключение — ртуть (Hg), которая находится в жидком состоянии при комнатной температуре. |
| Ковкость: | Металлы можно распределять молотком или разбивать на тонкие листы без разрушения, поскольку металлические связи в металлах не разрушаются легко. Золото (Au), серебро (Ag) — очень ковкие элементы. |
| Пластичность: | Способность металлов плавиться и вытягиваться в тонкую проволоку называется пластичностью. |
| Блеск: | Металлы обычно блестят и хорошо полируются. Электронная структура металлов такова, что они способны отражать падающий свет.Этот характерный металлический элемент называется блеском. |
| Проводник: | В металлах связи образуются избыточными или свободными электронами, движущимися вокруг большого массива атомов. Эти электроны способны проводить электричество и тепло. |
Плотность металлов
Плотность металлов высокая. Только натрий (Na) и калий (K) имеют меньшую плотность, чем вода. Таким образом, все металлы являются твердыми материалами, за исключением натрия, калия и свинца, которые являются мягкими металлами.
Селина Краткая химия, класс 8 Решения ICSE PDF
Selina Concise Chemistry Class 8 Решения ICSE были составлены опытными преподавателями с учетом последней программы ICSE и требований к экзаменам. Краткие химические решения Селины для 8 класса представляют собой прочную платформу для студентов, которые могут подготовить как можно больше вопросов и найти правильные ответы.
Selina Chemistry Решения класса 8 предназначены для предоставления максимальной информации студентам, готовящимся к экзаменам на доске.На вопросы даются пошаговые и легкие для понимания ответы. Обращаясь к ним, студенты могут очень быстро понять концепции, лежащие в основе решений. Это не только поможет студентам, давая им уверенность в ответах на всевозможные вопросы на экзаменах, но и гарантирует, что они усвоят концепции в долгосрочной перспективе. 8-й класс Selina Chemistry Solutions сосредоточен на правильных ответах на вопросы, чтобы побудить учащихся получить полные оценки на экзамене.
Selina Chemistry ICSE Класс растворов 8В 8-м классе ICSE химия является одним из самых сложных предметов, поскольку включает в себя все главы. Главы, представленные в учебнике, сложны, и студенты часто не понимают, какое решение является правильным. SelfStudys предоставляет Selina Chemistry Solutions для ICSE Class 8, чтобы они могли хорошо учиться на экзамене. Все химические решения Selina созданы нашими экспертами, имеющими большой академический опыт.
Наши решения Selina ICSE служат пошаговым руководством и необходимы при подготовке к экзамену. Решения Selina ICSE для класса 8 помогут вам лучше узнать концепции, чтобы вы могли учиться в любое время и в любом месте. Selina Chemistry ICSE Решения класса 8 доступны бесплатно и содержат подробные сведения обо всех главах. Наши решения по химии Selina ICSE для класса 8 выступают в качестве бесплатного руководства, которое поможет вам продвинуться вперед в вашей академической жизни.
Чтобы помочь большинству студентов подготовиться к этому предмету и получить хорошие оценки на экзаменах совета 8-го класса, решения Selina для 8-го класса можно бесплатно загрузить с нашего веб-сайта одним щелчком мыши.PDF также доступен для всех глав отдельно.
Селина, класс 8, краткие решения ICSE по химииSelina Concise Chemistry Solutions for Class 8 идеально подходит для подготовки к экзаменам на доске. Программа ICSE Class 8 обширна и требует сосредоточенных усилий со стороны студентов, чтобы успешно сдать экзамены. PDF-файл с решениями ICSE для класса 8 по химии Селины содержит подробные сведения по всем главам изучаемого предмета.Каждое объяснение дается со всеми предположениями и логикой, использованной для определения вывода. Это позволит студентам изучить и понять каждую концепцию, даже если они практикуются впервые.
Selina Publishers Класс 8 Преимущества решений ICSE:- Простые и надежные решения
- В наличии бесплатно
- Выделите важные вопросы экзамена
- Пошаговые решения по всем вопросам
- Подготовлено профильными экспертами
- Разработан в соответствии с последним шаблоном программы ICSE
- Доступно онлайн 24/7
Selina Решения ICSE для класса 8, на все вопросы ответят и объяснят опытные преподаватели в соответствии с рекомендациями совета ICSE.Изучив эти решения Selina ICSE для класса 8, вы легко сможете получить высокие оценки на экзаменах ICSE Class 8 Board.
SelfStudys дает вам конкурентное преимуществоНаша цель в SelfStudys — сделать обучение бесплатным, а также подготовить наших студентов к любым вопросам. Наша команда высококвалифицированных и преданных своему делу экспертов имеет обширный опыт и является выпускником некоторых ведущих колледжей страны. Они знают требования каждого ученика и корректируют свой стиль преподавания в соответствии со способностями каждого человека.
Студенты, которые пытаются усвоить концепции основных предметов, таких как математика, физика, химия или химия, могут загрузить наши решения и начать свою подготовку. Наша платформа идеальна даже для тех студентов, которые хотят сделать доработку перед экзаменом. Наши эксперты также регулярно информируют студентов об их успеваемости, чтобы они также знали, как продвигается их обучение.


 Габриелян О.С. и др. (2014, 224с.)
Габриелян О.С. и др. (2014, 224с.) С.
С.
 (Гремучая смесь из водорода и кислорода).
(Гремучая смесь из водорода и кислорода). Жидкости смешались и от них стали подниматься клубы фиолетового пара, образующие при оседании кристаллы с металлическим блеском и едким запахом. Это был йод).
Жидкости смешались и от них стали подниматься клубы фиолетового пара, образующие при оседании кристаллы с металлическим блеском и едким запахом. Это был йод). Методы очистки веществ
Методы очистки веществ
 Степень окисления. Составление формул по валентностям и степеням окисления
Степень окисления. Составление формул по валентностям и степеням окисления
 Растворимость
Растворимость
 Индикаторы
Индикаторы
 Катализаторы
Катализаторы
 Хлор и его соединения
Хлор и его соединения
 Соединения углерода
Соединения углерода
 Полимеры
Полимеры
 Химия и здоровье
Химия и здоровье
 Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества
 Теория химического строения органических веществ А. М. Бутлерова
Теория химического строения органических веществ А. М. Бутлерова
 Что является первым элементом периодической таблицы Менделеева?
Что является первым элементом периодической таблицы Менделеева? Верно или нет? У нейтрона нет чистого электрического заряда.
Верно или нет? У нейтрона нет чистого электрического заряда. Правда или ложь? Протон несет положительный заряд.
Правда или ложь? Протон несет положительный заряд. Также Примечания по химии GCSE Индекс ,
Также Примечания по химии GCSE Индекс ,  Общие основы химии
Общие основы химии Науки об атмосфере и Земле
Науки об атмосфере и Земле если ты
поймите это неправильно, появится НЕТ. Однако, если ваши первые три ответа неверны,
при 4-м щелчке, который является ответом, ничего не появляется! Боюсь, это
своеобразная причуда, в остальном отличная бесплатная загрузка Hot Potato
программное обеспечение, которое я использую.
если ты
поймите это неправильно, появится НЕТ. Однако, если ваши первые три ответа неверны,
при 4-м щелчке, который является ответом, ничего не появляется! Боюсь, это
своеобразная причуда, в остальном отличная бесплатная загрузка Hot Potato
программное обеспечение, которое я использую. The
Группа 1 Щелочные металлы
The
Группа 1 Щелочные металлы pH, индикаторы, кислоты,
Основы, нейтрализация и соли
pH, индикаторы, кислоты,
Основы, нейтрализация и соли  В
Добыча металлов
В
Добыча металлов  Тесты по физике на
Радиоактивность, радиоизотопы и ядерная энергия
Тесты по физике на
Радиоактивность, радиоизотопы и ядерная энергия