Практические работы по химии 8 класс | Методическая разработка по химии (8 класс) на тему:
Практическая работа № 1
Правила поведения в кабинете химии, приемы безопасной работы с оборудованием и веществами. Строение пламени
Цель:
Изучить приемы обращения с простейшим лабораторным оборудованием: лабораторным штативом, спиртовкой, пробирками, колбами и т. д. Изучить строение пламени. Изучить правила техники безопасности, которые требуется соблюдать при работе в школьном химическом кабинете.
Оборудование: спиртовка, лабораторный штатив, спички, пробирки, стаканчик с водой, баночка для отработанных реактивов, посуда химическая ( разная)
ход работы
- Правила по технике безопасности при работе в кабинете химии. ( работа с текстом учебника с. 9-10)
- Приемы обращения с лабораторным штативом. Зарисовать лабораторный штатив, подписать основные части, сделать вывод.
- Приемы обращения со спиртовкой. 9 сделать рисунок, сформулировать вывод)
- Изучение строения пламени.
 ( сделать рисунок, определить основные части пламени, сделать вывод.
( сделать рисунок, определить основные части пламени, сделать вывод. - Сделать общий вывод
Практическая работа 2
Очистка загрязненной поваренной соли.
Цель:
Научиться простейшим способам очистки веществ: фильтрованию и выпариванию. Научить выполнять практическую работу по инструкции и оформлять отчет о химическом эксперименте.
Оборудование и реактивы: пробирки, чаша для выпаривания растворов, спиртовка, спички, фильтровальная бумага, стакан с водой, загрязненная поваренная соль
Ход работы
- Инструктаж по ТБ при проведении практической работы.
- Растворение загрязненной поваренной соли.
- Очистка полученного раствора при помощи фильрования.
- Выпаривание раствора.
Учащиеся должны ответить на следующие вопросы:
1. Какими физическими свойствами (агрегатное состояние при обычных условиях, запах, цвет, растворимость в воде) обладают поваренная соль и речной песок?
2. Как разделить компоненты смеси, используя различия в их физических свойствах? Составьте план действий.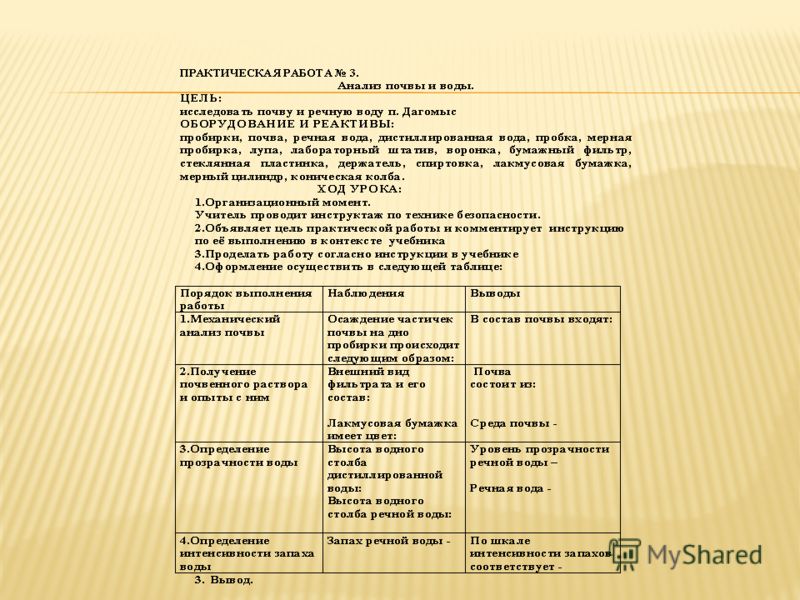
3. Какое оборудование вам потребуется для очистки поваренной соли?
Затем учащиеся приступают к выполнению практической работы (с. 52 учебника).
Отчет о работе учащиеся оформляют в тетрадях для практических занятий в виде таблицы.
Что сделали | Что наблюдали | Выводы |
|
|
|
Сформулировать общий вывод.
Практическая работа № 3
Получение и свойства кислорода
Цель: закрепить полученные знания о свойствах кислорода; продолжить формирование умений написания химических уравнений; повторить правила ТБ при проведении практических работ
Оборудование: штатив лабораторный, пробирки, газоотводные трубки, колбы, горелка, спички
Реактивы: перманганат калия, сера, уголь.
Ход работы:
- Правила ТБ
- Получение и собирание кислорода
- Горение угля и серы в кислороде
- Отчет о работе
Что делали | Что наблюдали | Выводы |
Практическая работа № 5
Приготовление растворов с определенной массовой долей растворенного вещества
Цель: закрепить полученные знания о массовой доле растворенного вещества, отработать навыки приготовления растворов с заданной концентрацией.
Оборудование урока: учебник, химическая посуда, весы лабораторные
Реактивы: вода, хлорид натрия, сульфат меди, карбонат кальция
Ход работы:
- Инструктаж по ТБ при проведении практической работы
- Произведение расчетов
- Взвешивание
- Приготовление раствора
- Отчет о выполнении работы выполняется в произвольной форме
Задания для практической работы:
Вариант 1
- Приготовьте 100 г раствора NaCl массовой долей 5 %
- Приготовьте 100 г раствора CuSO4 массовой долей 7 %
- Приготовьте 100 г раствора Ca CO3 массовой долей 10, 5%
Вариант 2.
1. Приготовьте 100 г раствора NaCl массовой долей 9 %
2. Приготовьте 70 г раствора CuSO4 массовой долей 3 %
3. Приготовьте 20 г раствора Ca CO3 массовой долей 12, 3%
Вариант 3
1. Приготовьте 35 г раствора NaCl массовой долей 4 %
2. Приготовьте 100 г раствора CuSO4 массовой долей 2,5 %
3. Приготовьте 48 г раствора Ca CO3 массовой долей 13, 5%
Вариант 4
1. Приготовьте 115 г раствора NaCl массовой долей 3,2 %
2. Приготовьте 79 г раствора CuSO4 массовой долей 8 %
3. Приготовьте 108 г раствора Ca CO3 массовой долей 15%
Вариант 5
1. Приготовьте 50 г раствора NaCl массовой долей 3,2 %
2. Приготовьте 60 г раствора CuSO4 массовой долей 8 %
3. Приготовьте 30 г раствора Ca CO3 массовой долей 15%
Практическая работа № 6.
Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений».
Цель: закрепить полученные знания об основных классах неорганических веществ отработать навыки написания уравнений реакций, умения делать выводы.
Оборудование: учебник, ПСХЭ, химическая посуда
Реактивы: соляная кислота гидроксид натрия, гидроксид меди, магний, оксид магния, хлорид меди
Ход работы:
- Инструктаж по ТБ при проведении практической работы
- Выполнение практической части.
- Решение задач № 1-5 вариант II
Оформить таблицу
Что делали | Что наблюдали | Выводы |
Задача№1 Определение соляной кислоты и гидроксида натрия, | Изменение окраски индикатора | Сформулировать вывод о изменении окраски используемых индикаторов |
Задача №2 Взаимодействие кислот и нерастворимых оснований | Растворение осадка | Написать уравнение реакции, сделать вывод |
Задача № 3 Определение раствора фенолфталеина | Изменение окраски индикатора | Сделать вывод |
Задача № 4 Получение хлорида магния используя имеющиеся реактивы | Написать уравнения реакций, сделать вывод |
Практические работы по химии 8 класс
Практическая работа №2
Наблюдение за горящей свечой
Цель работы: анализ физических и химических процессов, происходящих при горении свечи и определение скорости расходования кислорода во время горения.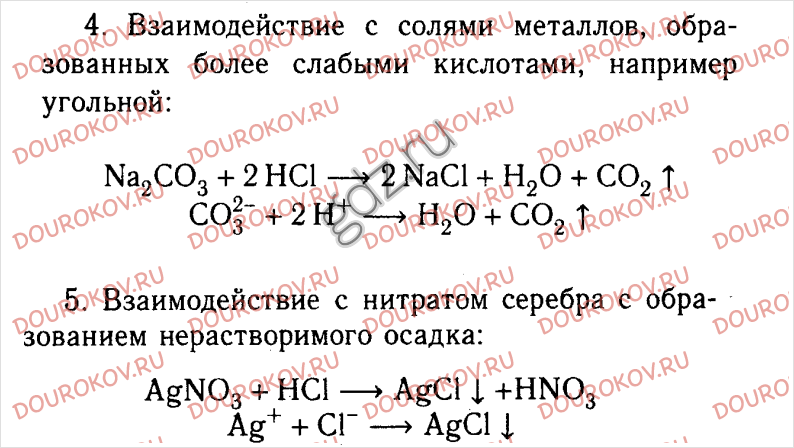
Оборудование: банки объемом 0,5л, 0,8л, 1л, 2л, секундомер, свеча, спички, рулетка,
Ход работы:
1. Вспомните правила поведения и техники безопасности при работе с веществами и оборудованием.
2. Внимательно слушай указания учителя.
1. Явления, происходящие при горении свечи.
Опыт №1. Физические явления при горении свечи.
Зажгите свечу. Вы увидите, как начинает таять парафин около фитиля, образуя круглую лужицу. Какой процесс здесь имеет место?
Опыт №2. Обнаружение продуктов горения в пламени.
А) Обнаружение углерода Закрепите предметное стекло в держателе и внесите в темную зону пламени, подержите 3 – 5 с. Объясните что там появилось.
Б) Обнаружение водорода Зафиксируйте перевернутую вверх дном сухую пробирку и подержите над пламенем свечи до запотевания, объясните наблюдаемое явление.
Запишите в виде таблицы, какие физические и химические процессы происходят при горении свечи.
Явления, происходящие при горении свечи
Физические явления | Химические явления |
2. Изучение скорости горения свечи
1. Подготовить таблицу для записи данных опыта.
Результаты изучения скорости горения свечи
| V (банки) , л | Время (t) , с |
2. Зажечь свечу и накрыть банкой объемом 0,5л.
3. Определить время (t), в течение которого горит свеча.
4. Провести подобные действия, используя банки других объемов.
5.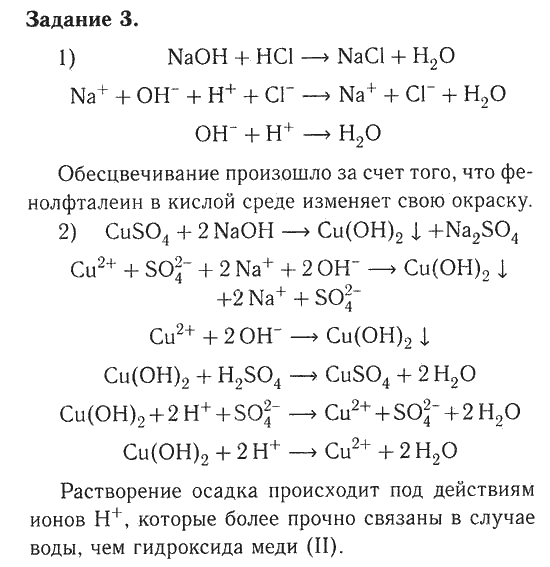 Выразить зависимость продолжительности горения свечи от объема банки в виде графика (построение произвести на миллиметровой бумаге или компьютере).
Выразить зависимость продолжительности горения свечи от объема банки в виде графика (построение произвести на миллиметровой бумаге или компьютере).
6. Определить объем классной комнаты.
7. Рассчитать, сколько времени будет гореть свеча, если в комнату не поступает воздух и весь кислород расходуется на горение свечи. Скорость расходования кислорода определить по графику из пункта 5.
8. Вывод: (Сделайте общий вывод по проделанной работе, исходя из цели урока)
Практическая работа №3.
«Анализ качества питьевой воды»
Цель: научиться простым способам определения качества питьевой воды.
Оборудование: образцы воды: водопроводная вода (из разных скважин), химические стаканы, кольцо из проволоки, индикаторная бумага, цилиндр, белый лист бумаги.
Ход работы:
1. Вспомните правила поведения и техники безопасности при работе с веществами и оборудованием.
2.
Задание1. Исследование органолептических показателей воды.
Налейте в стаканы воду из различных источников и проведите
органолептические исследования на окраску, прозрачность, запах:
Цвет (окраска). Для определения цветности воды возьмите стеклянный сосуд и лист белой бумаги. В сосуд наберите воду и на белом фоне бумаги определите цвет воды (голубой, зеленый, желтый, серый, коричневый) – показатель определенного вида загрязнения.
Прозрачность зависит от количества взвешенных частиц органического и неорганического происхождения. Для определения прозрачности воды используйте прозрачный мерный цилиндр с плоским дном, в который наливаем воду, подкладываем под цилиндр на расстоянии 4 см от его дна шрифт, высота букв которого 2 мм, а толщина линий букв – 0.5мм, и сливаем воду до тех пор, пока сверху через слой воды не будет виден этот шрифт. Измерим высоту столба воды в цилиндре линейкой и выразим степень прозрачности в см.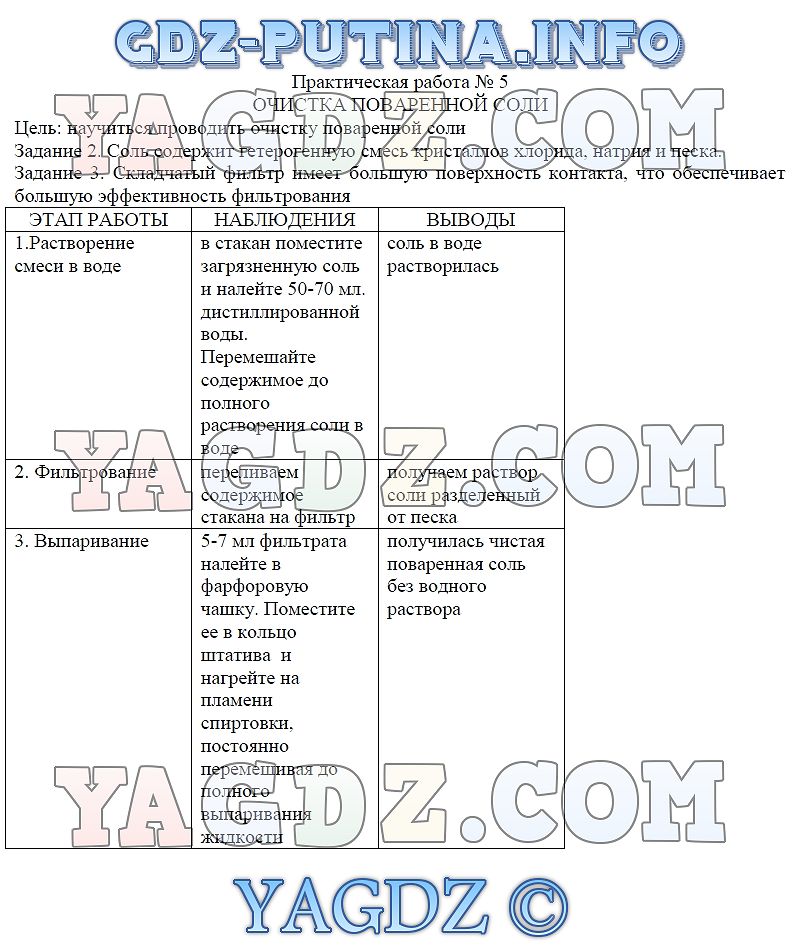
Запах зависит от биологических и химических загрязнителей. его оценивают по шкале
Оценка запаха воды
Интенсивность запаха | Описательное определение | Балл |
Нет | Отсутствие ощутимого запаха | 0 |
Очень слабый | Запах ощущается опытным наблюдателем, не ощущается потребителем | 1 |
Слабый | Обнаруживается, если обратить внимание | 2 |
Заметный | Ощущается легко | 3 |
Отчетливый | Запах обращает на себя внимание, делает воду неприятной для питья | 4 |
Очень сильный | Настолько сильный, что вода совершенно непригодна для питья | 5 |
Характер и род запаха воды естественного происхождения
Характер запаха | Примерочный род запаха |
Ароматический | Огуречный, цветочный |
Болотный | Илистый, тинистый |
Гнилостный | Фекальный, сточной воды |
Древесный | Мокрой щепы, древесной коры |
Землистый | Прелый, свежевспаханой земли |
Плесневый | Затхлый, застойный |
Сероводородный | Тухлых яйц |
Травянистый | Скошенной травы |
Неопределенный | Не подходящий под предыдущие определения |
По результатам исследования заполните таблицу:
№ пробы | Природа исследуемого вещества | Цвет | Прозрачность | Запах |
1. | Вода из колодца | |||
2. | Водопроводная вода (с. Большая Арать) | |||
3. | Водопроводная вода (с. Сыченки) |
Задание 2. Водородный показатель воды (pH)
Питьевая вода должна иметь нейтральную реакцию (pH около 7). Значение pH воды водоемов хозяйственного, питьевого, культурно-бытового назначения регламентируется в пределах 6,5-8,5.
Определить значение рН можно с помощью универсальной индикаторной бумаги, сравнивая ее окраску со шкалой.
№ пробирки | Природа исследуемого вещества | Окраска индикатора | рН среда |
Задание 3. Сравнение жесткости различных образцов воды
Сравнение жесткости различных образцов воды
В жесткой воде мыло образует хлопья (нерастворимые соединения кальция).
Повышенная концентрация солей в воде ухудшает вкус питьевой воды.
Для хозяйственно-бытовых нужд требуется мягкая вода или вода с очень незначительной жесткостью, т.к. при кипячении жесткой воды образуется накипь. При стирке тканей в жесткой воде образуются нерастворимые соединения (стеараты кальция), которые осаждаются на поверхности тканей и постепенно разрушают волокна. В жесткой воде плохо развариваются продукты. Употребление жесткой воды увеличивает опасность мочекаменной болезни, неблагоприятно влияет на состояние сосудов, приводит к отложению солей.
В три пробирки наливают воду из различных источников по 10-15 мл:
В каждую пробирку бросают кусочек мыла и сильно встряхивают пробирку (около 5 минут). Дают, отстоятся и описывают внешний вид полученных растворов: есть ли осадок в виде хлопьев, много осадка или мало, раствор почти прозрачный и т. д. результаты заносят в таблицу.
д. результаты заносят в таблицу.
Образец воды | Характеристика полученного раствора |
Вывод: (Сделайте общий вывод по проделанной работе, исходя из цели урока)
Практическая работа № 4.
Приготовление растворов с заданной массовой долей растворенного вещества.
Цель работы: научиться готовить растворы с определенной массовой долей растворенного вещества, производить теоретические расчеты, которые можно применить на практике.
Оборудование: весы, мерный цилиндр, ложечка, химический стакан, стеклянная палочка, вода, соли (карбонат натрия, сульфат меди 2, хлорид бария)
1. Вспомните правила поведения и техники безопасности при работе с веществами и оборудованием.
2. Внимательно слушай указания учителя.
Ход работы:
1. этап работы: Расчетная часть.
1. Получив задание от учителя, произведи расчет для выполнения практической работы.
1 вариант. Для проведения лабораторных и практических работ приготовьте 30 г раствора медного купороса (сульфат меди 2) с массовой долей соли 3%.
2 вариант. Для школьной аптечки приготовьте 100 г 2%-го водного раствора питьевой соды (гидрокарбонат натрия), который используют для обработки кожи после ожога кислотой.
3 вариант. Для школьной аптечки приготовьте 100 г 2%-го водного раствора борной кислоты для обработки глаз и кожи после попадания щелочи.
4 вариант. Для проведения лабораторных и практических работ приготовьте 25 г раствора хлорида бария с массовой долей соли 2%.
2. этап работы: Взвешивание навески вещества.
1. На весах взвесьте требуемую навеску вещества, и высыпьте ее в стаканчик.
3. этап работы: Измерение объема воды.
1. Мерным цилиндром отмерьте рассчитанный объем воды и вылейте ее в стакан с сахаром.
4. этап работы: Приготовление раствора с заданной массовой долей вещества.
1. Перемешайте стеклянной палочкой вещество с водой до полного его растворения.
5. Приготовьте этикетку с указанием формулы вещества, его массовой доли и кто приготовил.
Вывод: (Сделайте общий вывод по проделанной работе, исходя из цели урока)
Литература:
-Габриелян О.С. химия. 8 класс.-М.: Дрофа, 2008
-Исаев Д.С. Практические работы исследовательского характера по неорганической химии: Учебное пособие для учащихся 8-х классов. Тверь: Твер. гос. ун-т, 2001.- 56 с.: ил.
8 класс — 360 Химия
Практическая работа №1 Приемы обращения с лабораторным оборудованием
Цель работы: научиться правильно обращаться с лабораторным оборудованием; изучить строение пламени. Оборудование: штатив с зажимами, лапкой и кольцом, асбестовая сетка, спиртовка, спички, колба. Ход работы: 1. Рассмотрите составные части лабораторного штатива, уясните их значение. 2. Соберите лабораторный штатив и закрепите на нем колбу (плечо зажима, удерживающего лапку и кольцо, должно быть снизу). 3. Зарисуйте в тетрадь собранный штатив и подпишите все детали. 4. Рассмотрите устройство спиртовки и зарисуйте его в тетрадь. 5. Прочитайте правила обращения со спиртовкой. 6. Письменно ответьте на вопросы: А) почему нельзя нагревать жидкость в толстостенной посуде? Б) почему сначала прогревают всю пробирку и только затем – ту часть, где находится вещество? В) куда направляют отверстие пробирки при нагревании вещества? 7. Включите спиртовку, изучите строение пламени и зарисуйте его в тетрадь. Потушите спиртовку. 8.
Практическая работа №3
Получение кислорода и изучение его свойств
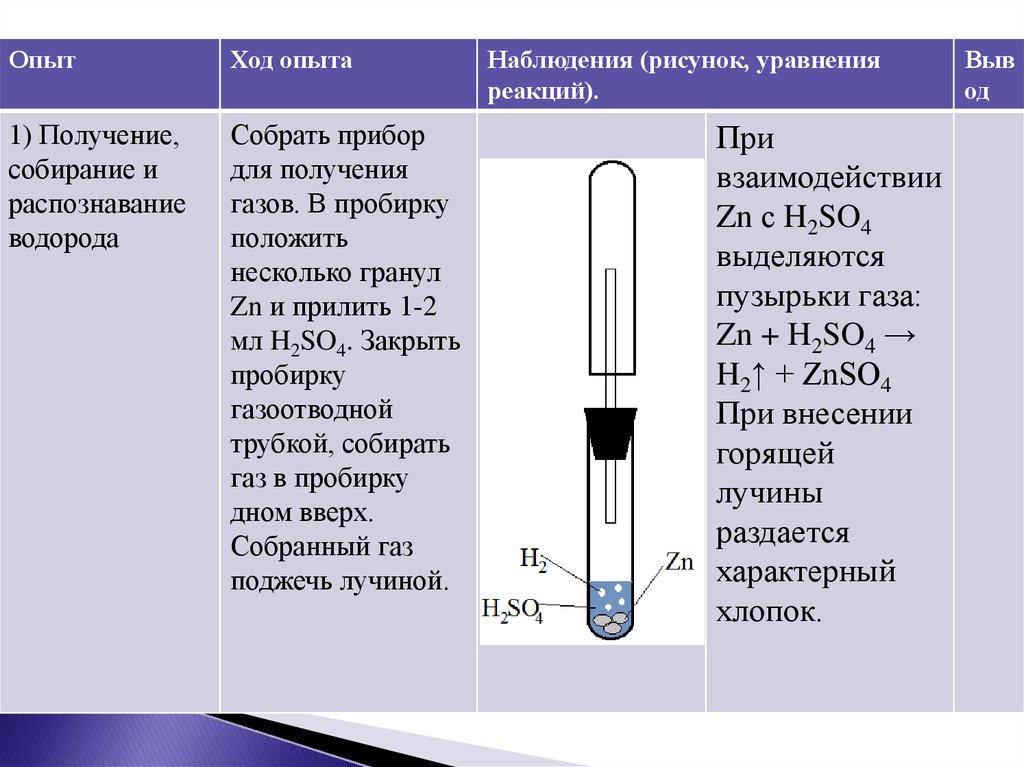
Цель работы: получить кислород разложением перманганата калия и каталитическим разложением перекиси водорода; на примере конкретных химических реакций изучить свойства кислорода. Оборудование и реактивы: приборы для получения газа, штатив с пробирками, железные ложечки дл я сжигания веществ, спиртовка, спички, держатель, штатив лабораторный; перманганат калия, уголь, известковая вода.
Порядок выполнения работы 1. Соберите прибор для получения газа, поместите в него перманганат калия (до 1/5 объема пробирки), введите в пробирку небольшой ватный тампон. Укрепите прибор в лапке лабораторного штатива так, чтобы конец газоотводной трубки доходил почти до дна пробирки, в которую будет собираться кислород. 2. В пробирку с кислородом внесите ложечку с тлеющим угольком (заранее разогрейте уголек в пламени спиртовки). Что наблюдаете? Когда горение прекратится, выньте ложечку из пробирки, добавьте в нее известковой воды и взболтайте. Почему происходит помутнение известковой воды? По итогам проведенных экспериментов заполните таблицу, сделайте вывод.
Практическая работа №4 Приготовление растворов с определенной массовой долей растворенного вещества Цель работы: научиться взвешивать вещества; приготовит раствор соли заданной концентрации. Оборудование и реактивы: стакан химический, стеклянная палочка, измерительный цилиндр (мензурка), весы с разновесами; кристаллический хлорид натрия, вода. Порядок выполнения работы Задание 1. Рассчитайте, какую массу хлорида натрия и какой объем воды надо взять для приготовления 50г 1,5%-го раствора хлорида натрия. Задание 2. Приготовьте этот раствор: 1. Приведите в равновесие чашечки весов. 2. Отвесьте рассчитанную массу соли. 3. С помощью мензурки отмерьте рассчитанный объем воды. 4. В химическом стакане растворите соль в воде, перемешивая раствор стеклянной палочкой. Задание 3. Добавьте к полученному раствору 150г воды. Рассчитайте как при этом изменится концентрация раствора (массовая доля растворенного вещества). Запишите в тетрадь необходимые расчеты, сделайте по итогам работы вывод. Образец оформления работы Задание 1.
Задание 2.
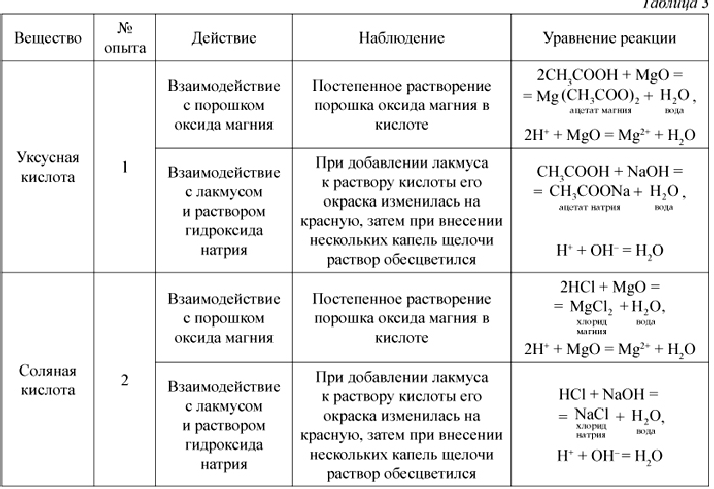
Практическая работа №5 Способы распознавания кислот, щелочей и солей Цель работы: на примерах конкретных химических реакций закрепит знания об основных классах неорганических веществ. Оборудование и реактивы: штатив с пробирками; соляная кислота, растворы гидроксида натрия, карбоната калия, хлорида натрия, нитрата серебра, сульфата натрия, хлорида бария, лакмуса, фенолфталеина. Порядок выполнения работы 1. Налейте в пробирку 2-3 мл раствора гидроксида натрия, добавьте несколько капель фенолфталеина. 2. Налейте в пробирку 2-3 мл соляной кислоты, добавьте несколько капель лакмуса. Сделайте вывод о способе распознавания кислот. 3. Налейте в пробирку 2-3 мл карбоната калия, добавьте такой же объем соляной кислоты. Сделайте вывод о способе распознавания карбонатов. 4. Налейте в пробирку 2-3 мл раствора хлорида натрия, добавьте несколько капель раствора нитрата серебра. Сделайте вывод о способе распознавания хлоридов. 5. Налейте в пробирку 2-3 мл раствора сульфата натрия, добавьте такой же объем раствора хлорида бария. Сделайте вывод о способе распознавания сульфатов. По итогам проведенных опытов заполните таблицу, сделайте вывод.
Образец оформления работы
Практическая работа №6 Экспериментальное исследование амфотерности Вариант 1 Цель работы: провести опыты, подтверждающие двойственную природу алюминия, а также его гидроксида. Оборудование и реактивы: штатив с пробирками; алюминий в гранулах, соляная кислота, растворы гидроксида натрия, хлорида алюминия. Порядок выполнения работы Задание 1. Исследуйте явление амфотерности на примере простого вещества: В две пробирки поместите по грануле алюминия и добавьте в первую пробирку немного соляной кислоты, а во вторую – концентрированной щелочи (гидроксида натрия). В случае если во второй пробирке реакция будет протекать медленно, подогрейте содержимое пробирки. Наблюдайте растворение алюминия, выделение газа, сделайте вывод о двойственной природе алюминия. Задание 2. Получите амфотерный гидроксид и докажите его двойственную природу: 1. Налейте в пробирку 3-4 мл раствора хлорида алюминия, аккуратно, по каплям прибавьте раствор гидроксида натрия до образования белого студенистого осадка гидроксида алюминия (прибавление большого количества щелочи к соли сразу приведет к растворению выпавшего осадка). 2. Полученный осадок разделите на две части. К первой прибавьте немного соляной кислоты, а ко второй – раствор гидроксида натрия. Наблюдайте растворение осадков в обоих случаях, сделайте вывод о двойственной природе гидроксида алюминия. По результатам проведенных опытов заполните таблицу, сделайте вывод.
Вариант 2 Цель работы: провести опыты, подтверждающие двойственную природу цинка, а также его гидроксида. Оборудование и реактивы: штатив с пробирками; цинк в гранулах, соляная кислота, растворы гидроксида натрия, хлорида цинка. Порядок выполнения работы Задание 1. Исследуйте явление амфотерности на примере простого вещества: В две пробирки поместите по грануле цинка и добавьте в первую пробирку немного соляной кислоты, а во вторую – концентрированной щелочи (гидроксида натрия). В случае если во второй пробирке реакция будет протекать медленно, подогрейте содержимое пробирки. Наблюдайте растворение цинка, выделение газа, сделайте вывод о двойственной природе цинка. Задание 2. Получите амфотерный гидроксид и докажите его двойственную природу: 1. Налейте в пробирку 3-4 мл раствора хлорида цинка, аккуратно, по каплям прибавьте раствор гидроксида натрия до образования белого студенистого осадка гидроксида цинка (прибавление большого количества щелочи к соли сразу приведет к растворению выпавшего осадка). 2. По результатам проведенных опытов заполните таблицу, сделайте вывод.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Естественные науки 8 класс Содержание
- Глава 1: Фотосинтез и дыхание
- 1.
 1 Фотосинтез
1 Фотосинтез - 1.2 Дыхание
- 1.3 Резюме
- 1.
- Глава 2: Взаимодействие и взаимозависимость в среде
- 2.1 Что такое экология?
- 2.2 Экосистемы
- 2.
 3 Кормовые отношения
3 Кормовые отношения - 2.4 Поток энергии: пищевые цепи и пищевые сети
- 2.5 Баланс в экосистеме
- 2.6 Адаптации
- 2.7 Сохранение экосистемы
- 2.8 Резюме
- Глава 3: Микроорганизмы
- 3.
 1 Типы микроорганизмов
1 Типы микроорганизмов - 3.2 Вредоносные микроорганизмы
- 3.3 Полезные микроорганизмы
- 3.4 Резюме
- 3.
- Глава 4: Глоссарий жизни и быта
- 4.1 Глоссарий жизни и быта
- Глава 5: Атомы
- 5.
 1 Строительные блоки материи
1 Строительные блоки материи - 5.2 Субатомные частицы
- 5.3 Чистые вещества
- 5.4 Смеси элементов и соединений
- 5.5 Резюме
- 5.
- Глава 6: Модель частиц материи
- 6.
 1 Что такое корпускулярная модель материи?
1 Что такое корпускулярная модель материи? - 6.2 Твердые тела, жидкости и газы
- 6.3 Изменения состояния
- 6.4 Плотность, масса и объем
- 6.5 Плотность и состояния вещества
- 6.6 Плотность различных материалов
- 6.
 7 Расширение и сжатие материалов
7 Расширение и сжатие материалов - 6.8 Давление
- 6.9 Резюме
- 6.
- Глава 7: Химические реакции
- 7.1 Как узнать, что произошла химическая реакция?
- 7.2 Реагенты и продукты
- 7.
 3 Резюме
3 Резюме
- Глава 8: Глоссарий Материи и Материалов
- 8.1 Глоссарий материи и материалов
- Глава 9: Статическое электричество
- 9.1 Трение и статическое электричество
- 9.2 Резюме
- Глава 10: Передача энергии в электрических системах
- 10.
 1 Цепи и текущее электричество
1 Цепи и текущее электричество - 10.2 Компоненты цепи
- 10.3 Воздействие электрического тока
- 10.
- Глава 11: Последовательные и параллельные схемы
- 11.1 Последовательные цепи
- 11.2 Параллельные цепи
- 11.
 3 Другие устройства вывода
3 Другие устройства вывода
- Глава 12: Видимый свет
- 12.1 Излучение света
- 12.2 Спектр видимого света
- 12.3 Непрозрачные и прозрачные вещества
- 12.4 Поглощение света
- 12.
 5 Отражение света
5 Отражение света - 12.6 Как мы видим свет?
- 12.7 Преломление света
- Глава 13: Глоссарий энергии и изменений
- 13.1 Глоссарий энергии и изменений
- Глава 14: Солнечная система
- 14.
 1 Солнце
1 Солнце - 14.2 Объекты вокруг Солнца
- 14.3 Положение Земли в Солнечной системе
- 14.
- Глава 15: За пределами Солнечной системы
- 15.1 Галактика Млечный Путь
- 15.2 Наша ближайшая звезда
- 15.
 3 Световые годы, световые часы и световые минуты
3 Световые годы, световые часы и световые минуты - 15.4 Что находится за пределами Галактики Млечный Путь?
- Глава 16: Глядя в космос
- 16.1 Ранний просмотр космоса
- 16.2 Телескопы
- Глава 17: Планета Земля и не только Глоссарий
- 17.
 1 Планета Земля и не только Глоссарий
1 Планета Земля и не только Глоссарий
- 17.
Книга для учащихся и руководство для учителя (PDF 8A, PDF 8B)
книга для учащихся (электронная публикация)
- Формулы физики
- Химические формулы
- Периодическая таблица элементов
- Физические константы
химия | Определение, темы, типы, история и факты
молекулярная структура
Посмотреть все СМИ
- Ключевые люди:
- Джордж П. Смит Йошино Акира Бенджамин Лист Дэвид В.К. Макмиллан Джон Б. Гуденаф
- Связанные темы:
- химическая связь химический элемент химическое соединение биохимия химическая реакция
Просмотреть весь связанный контент →
Популярные вопросы
Что такое химия?
Химия — это отрасль науки, изучающая свойства, состав и структуру элементов и соединений, их изменения и энергию, которая выделяется или поглощается при их изменении.
Как связаны химия и биология?
Химия изучает вещества, то есть элементы и соединения, а биология изучает живые существа. Однако эти две отрасли науки встречаются в дисциплине биохимии, изучающей вещества в живых существах и то, как они изменяются в организме.
Резюме
Прочтите краткий обзор этой темы
химия , наука, изучающая свойства, состав и структуру веществ (определяемых как элементы и соединения), превращения, которые они претерпевают, и энергию, которая выделяется или поглощается в ходе этих процессов. Каждое вещество, встречающееся в природе или искусственно созданное, состоит из одного или нескольких из сотен с лишним видов атомов, которые были идентифицированы как элементы. Хотя эти атомы, в свою очередь, состоят из более элементарных частиц, они являются основными строительными блоками химических веществ; нет, например, количества кислорода, ртути или золота, меньшего, чем атом этого вещества. Таким образом, химия занимается не субатомной областью, а свойствами атомов и законами, управляющими их комбинациями, и тем, как знание этих свойств может быть использовано для достижения конкретных целей.
Таким образом, химия занимается не субатомной областью, а свойствами атомов и законами, управляющими их комбинациями, и тем, как знание этих свойств может быть использовано для достижения конкретных целей.
Большой проблемой в химии является разработка последовательного объяснения сложного поведения материалов, почему они выглядят именно так, как они выглядят, что придает им их устойчивые свойства и как взаимодействие между различными веществами может привести к образованию новых веществ и разрушение старых. С самых ранних попыток понять материальный мир в рациональных терминах химики изо всех сил пытались разработать теории материи, которые удовлетворительно объясняли бы как постоянство, так и изменение. Упорядоченная сборка неразрушимых атомов в маленькие и большие молекулы или протяженные сети перемешанных атомов обычно считается основой постоянства, в то время как реорганизация атомов или молекул в различные структуры лежит в основе теорий изменения. Таким образом, химия включает в себя изучение атомного состава и структурной архитектуры веществ, а также различных взаимодействий между веществами, которые могут привести к внезапным, часто бурным реакциям.
Химия также занимается использованием природных веществ и созданием искусственных. Кулинария, ферментация, производство стекла и металлургия — все это химические процессы, восходящие к зарождению цивилизации. Сегодня винил, тефлон, жидкие кристаллы, полупроводники и сверхпроводники представляют собой плоды химической технологии. В 20-м веке произошел значительный прогресс в понимании удивительной и сложной химии живых организмов, и молекулярная интерпретация здоровья и болезней имеет большие перспективы. Современная химия, с помощью все более сложных инструментов, изучает материалы, такие маленькие, как отдельные атомы, и такие большие и сложные, как ДНК (дезоксирибонуклеиновая кислота), которая содержит миллионы атомов. Можно даже разработать новые вещества, обладающие желаемыми характеристиками, а затем синтезировать их. Скорость, с которой химические знания продолжают накапливаться, поразительна. С течением времени было охарактеризовано и произведено более 8 000 000 различных химических веществ, как природных, так и искусственных.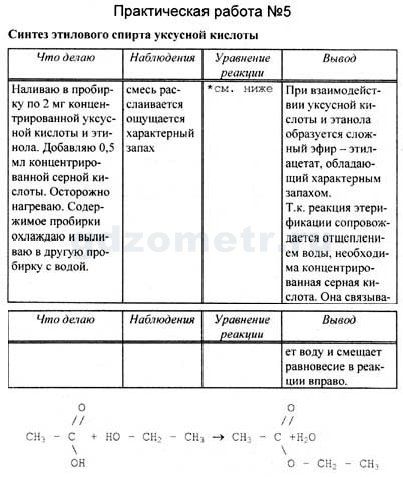 Это число было менее 500 000 еще в 19 году.65.
Это число было менее 500 000 еще в 19 году.65.
С интеллектуальными задачами химии тесно связаны задачи, связанные с промышленностью. В середине 19 века немецкий химик Юстус фон Либих заметил, что богатство нации можно измерить по количеству произведенной ею серной кислоты. Эта кислота, необходимая для многих производственных процессов, остается сегодня ведущим химическим продуктом в промышленно развитых странах. Как признавал Либих, страна, производящая большое количество серной кислоты, имеет сильную химическую промышленность и сильную экономику в целом. Производство, распределение и использование широкого спектра химических продуктов характерны для всех высокоразвитых стран. Фактически можно сказать, что «железный век» цивилизации сменяется «полимерным веком», так как в некоторых странах общий объем производимых сейчас полимеров превышает объем железа.
Викторина «Британника»
Лица науки
Галилео Галилей. Андерс Цельсий. Вы можете узнать их имена, но знаете ли вы, кто они на самом деле? Соберите свои данные и проверьте свои знания об известных ученых в этой викторине.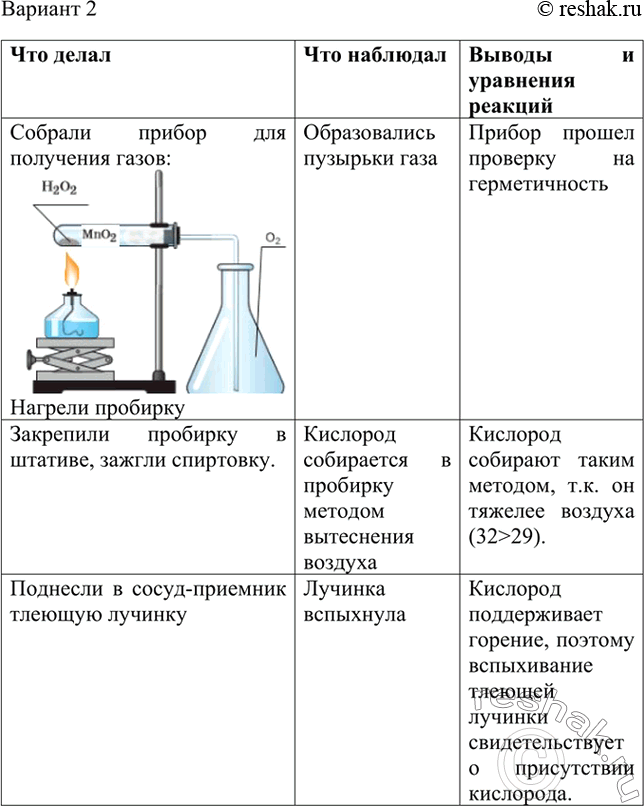
Давно прошли те времена, когда один человек мог надеяться на детальное знание всех областей химии. Те, кто преследует свои интересы в конкретных областях химии, общаются с другими людьми, разделяющими те же интересы. Со временем группа химиков со специализированными исследовательскими интересами становится основателями области специализации. Области специализации, возникшие в начале истории химии, такие как органическая, неорганическая, физическая, аналитическая и промышленная химия, наряду с биохимией, сохраняют наибольший общий интерес. Однако в 20-м веке произошел значительный рост в области полимерной, экологической и медицинской химии. Более того, продолжают появляться новые специальности, как, например, пестицидная, криминалистическая, компьютерная химия.
8 Развитие научных навыков для учащихся
Изучение естественных наук предполагает развитие важных навыков, в том числе жизненных навыков.
Приведенный ниже список относится к изучению любой области науки (химии, биологии, физики) на любом уровне обучения. Сосредоточившись на развитии этих навыков научного процесса, вы поможете своим ученикам не только запомнить научный метод, но и применить его на практике.
Сосредоточившись на развитии этих навыков научного процесса, вы поможете своим ученикам не только запомнить научный метод, но и применить его на практике.
Включает базовые и интегрированные научные навыки.
Некоторым из этих навыков, например, наблюдательности, хотя и присущи инстинкты, все же нужно учиться. Почему? Отвлечения! Они повсюду и оставлены без внимания, мешают обучению.
Эти навыки полностью применимы к другим предметам и жизненным ситуациям.
Научные навыки для обучения
Наблюдение . Это самый фундаментальный из научных навыков. Это потому, что большинство студентов рождаются с пятью чувствами, которые определяют, как они воспринимают мир.
Наблюдение требует, чтобы учащиеся отмечали «общую картину» и мелкие детали.
Поощряйте учащихся подробно описывать то, что они видят; это поможет им определить свойства и сделать более обоснованные гипотезы. Например, при изучении ботаники попросите их сделать больше, чем просто отметить цвет и форму цветка. Пусть они посчитают лепестки, нарисуют листья и посмотрят на пыльцу под увеличительным стеклом.
Пусть они посчитают лепестки, нарисуют листья и посмотрят на пыльцу под увеличительным стеклом.
Cl assifying – Этот навык основан на наблюдательности. Студенты могут научиться разделять и сортировать объекты на основе свойств. Младшие школьники могут научиться сортировать по одному фактору (например, по количеству ног: у пауков их восемь, а у насекомых — шесть), а старшие ученики могут классифицировать сразу по нескольким факторам.
Преподавание классификации также является прекрасным временем для введения новых словарных слов. Вы можете предложить учащимся попрактиковаться в использовании этих слов, записав их в тетради по науке, или, для младших школьников, заучив песню или стихотворение, используя новые слова. Это отличный способ пересечь
Количественная оценка . Одним из самых ценных навыков, необходимых для изучения науки, является способность точно измерять.
Вы можете начать с обучения младших школьников тому, как пользоваться линейкой и мерным стаканом. По мере взросления они будут приобретать более сложные навыки измерения с использованием математических уравнений и передового оборудования.
По мере взросления они будут приобретать более сложные навыки измерения с использованием математических уравнений и передового оборудования.
Предсказание . Этот навык вытекает из того, что ваши ученики могут выявлять закономерности в прошлых экспериментах или существующих доказательствах (т. е. в мире природы).
Прогнозирование — это обоснованное предположение о том, что может произойти, когда вы вносите изменения.
Перед выполнением любого эксперимента спросите детей, что, по их мнению, произойдет, и попросите их записать свои предположения. Объясните, что это называется выдвижением гипотезы . Направляйте младших школьников, задавая такие вопросы, как: Сколько в банке? Сколько это весит? Что произойдет, если мы добавим что-то еще? Продвинутые учащиеся смогут делать более подробные прогнозы или гипотезы на основе того, что они уже знают.
Контролирующие переменные — На результат эксперимента может повлиять множество различных факторов. Вы можете помочь учащимся понять это, обсудив возможные факторы перед началом. Это обеспечивает контекст.
Вы можете помочь учащимся понять это, обсудив возможные факторы перед началом. Это обеспечивает контекст.
После проведения эксперимента предложите им изменить один переменный фактор и повторить попытку.
Интерпретация — Этот навык тесно связан с выводом, что означает делать вывод после анализа информации. Интерпретация, вывод, с точки зрения. Два студента могут интерпретировать результаты эксперимента по-разному.
Учащиеся должны попытаться понять результаты на основе записей, которые они ведут. Их интерпретация должна соответствовать тенденции или общей картине эксперимента.
Если учащиеся не уверены, почему эксперимент оказался именно таким, вы можете предложить им провести дополнительные исследования.
Общение — Этот навык касается всех остальных. Учащиеся должны уметь передавать информацию с помощью слов, таблиц, диаграмм и других средств.
Вы должны обратить внимание учащихся на важность использования правильного языка при общении с аудиторией (учителя/родители, семья, друзья/одноклассники).
Обсудите с ними также важность использования точных вспомогательных средств (таблиц, диаграмм и т. д.). Как говорится, картинка стоит тысячи слов. Зрители часто смотрят на картинки из проекта, не читая слов. Это может привести их к одному или нескольким неверным выводам.
Формирование выводов – Этот навык связан с интерпретацией. Студенты не могут делать поспешных выводов; они должны быть достигнуты путем тщательного рассуждения.
При формировании выводов попросите учащихся оглянуться на свои прогнозы и сравнить их с фактическими результатами. Убедитесь, что они принимают во внимание всю собранную информацию, делая выводы.
Научные навыки, связанные с научным методом
Многим из этих навыков можно научиться с помощью научного метода . Четыре шага научного метода заключаются в том, чтобы сделать наблюдения, выдвинуть гипотезу, проверить свою гипотезу и сделать вывод. Каждый шаг научного метода может включать в себя множество научных навыков, таких как интерпретация данных при формировании вывода или контроль переменных при проверке гипотезы.


 ( сделать рисунок, определить основные части пламени, сделать вывод.
( сделать рисунок, определить основные части пламени, сделать вывод.



 Сделайте вывод о способе распознавания щелочей.
Сделайте вывод о способе распознавания щелочей.

 Полученный осадок разделите на две части. К первой прибавьте немного соляной кислоты, а ко второй – раствор гидроксида натрия. Наблюдайте растворение осадков в обоих случаях, сделайте вывод о двойственной природе гидроксида цинка.
Полученный осадок разделите на две части. К первой прибавьте немного соляной кислоты, а ко второй – раствор гидроксида натрия. Наблюдайте растворение осадков в обоих случаях, сделайте вывод о двойственной природе гидроксида цинка.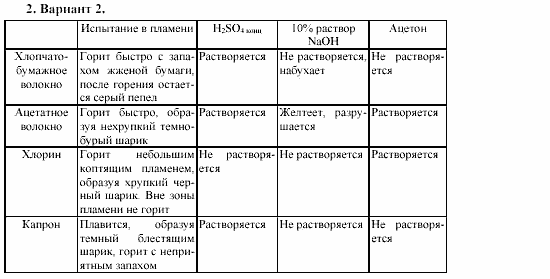 1 Фотосинтез
1 Фотосинтез 3 Кормовые отношения
3 Кормовые отношения 1 Типы микроорганизмов
1 Типы микроорганизмов 1 Строительные блоки материи
1 Строительные блоки материи 1 Что такое корпускулярная модель материи?
1 Что такое корпускулярная модель материи?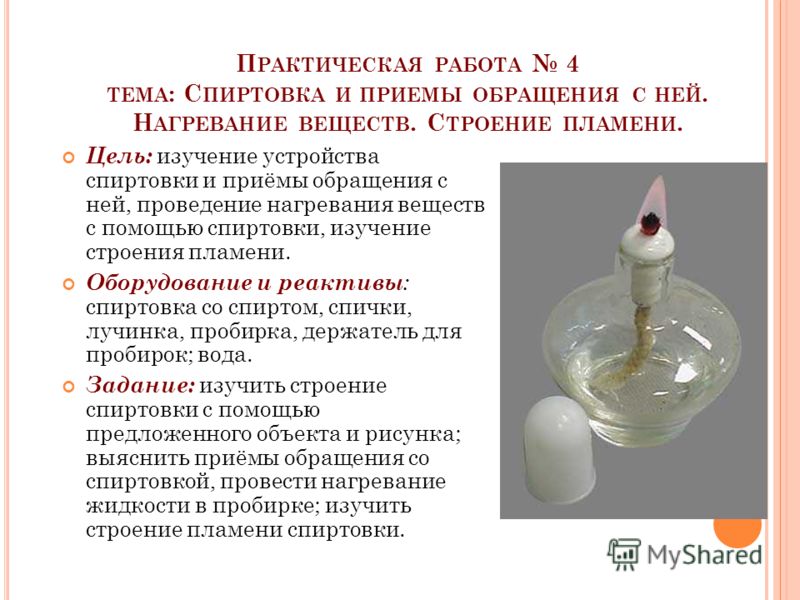 7 Расширение и сжатие материалов
7 Расширение и сжатие материалов 3 Резюме
3 Резюме 1 Цепи и текущее электричество
1 Цепи и текущее электричество 3 Другие устройства вывода
3 Другие устройства вывода 5 Отражение света
5 Отражение света 1 Солнце
1 Солнце 3 Световые годы, световые часы и световые минуты
3 Световые годы, световые часы и световые минуты 1 Планета Земля и не только Глоссарий
1 Планета Земля и не только Глоссарий